*僅供醫學專業人士閱讀參考
乳腺癌是高度異質性腫瘤,關於乳腺癌HER2異質性有哪些關鍵問題?
自人類表皮生長因子受體2(HER2)被確定為乳腺癌的治療靶點以來,隨後開發出一系列抗HER2靶向療法,可以說徹底改變了HER2陽性乳腺癌的治療局面。然而,腫瘤中頻繁可見的HER2低表達或異質性表達正在被逐漸關注。不同的HER2表達會影響到傳統抗HER2靶向治療的獲益程度,而隨著新型ADC藥物的出現,使得HER2低表達乳腺癌同樣成為抗HER2靶向治療獲益人群。同時許多研究報導了HER2異質性的存在與較短的無病生存期(DFS)和總生存期(OS)之間的相關性。臨床上需要對能夠識別HER2異質性的技術進行更多驗證,並開發有效治療HER2表達不均勻的抗腫瘤藥物。一篇題為《Targeting HER2 heterogeneity in breast cancer》的研究報導對相關內容進行了闡述[1],本文對其重點內容進行了梳理。
HER2異質性概述
HER2在20世紀80年代中期被確定為一種刺激腫瘤生長的致癌基因。HER2是一個跨膜的酪氨酸激酶(TK)受體,與HER受體家族的另一個成員EGFR(HER1)形成活躍的二聚體。隨後受體上酪氨酸殘基的磷酸化導致細胞內信號通路的激活,促進細胞生長和增殖。HER2在大約20-25%的乳腺癌中過表達[2],這種過表達主要是基因擴增的結果,並且HER2過表達提示乳腺癌患者預後較差[3]。
HER2過表達和預後不良之間的關係促使人們尋找能抑制HER2活性的方法,由此激發了諸如單克隆抗體、酪氨酸激酶抑制劑、ADC藥物等的開發。這些抗HER2療法的療效在通過免疫組化(IHC)檢測HER2過表達(3+)或通過螢光原位雜交(FISH)檢測HER2基因擴增的乳腺癌中最為明顯。多年來,HER2檢測方法已經得到了標準化,具體的檢測標準也已得到建立和不斷更新。
隨著新型ADC藥物的發展,最近的研究已經轉向探索HER2低表達乳腺癌患者對HER2靶向ADC療法的應答。HER2低表達被定義為IHC 1+或IHC 2+且滿足FISH檢測HER2無擴增。這些患者大多數為激素受體(HR)陽性(65%-83%)腫瘤。HER2低表達乳腺癌常見的一些臨床病理學特徵包括:腫瘤體積較大、組織病理學分級較高、增殖指數較高、腋窩淋巴結轉移較多,這在臨床上與HER2陽性患者相似[4]。此外,HR陽性/HER2低表達腫瘤的分子特徵與HR陰性疾病有區別,包括遺傳、臨床病理和預後差異等,且HR陰性/HER2低表達腫瘤以基底細胞樣表型為主[5]。
HER2異質性,即指同一腫瘤在不同位置或不同時間段HER2的不同表達或擴增狀態,在高達34%的乳腺癌病例中可以看到異質性相關報導[6-9]。這種現象在IHC和/或FISH檢測HER2結果不明確的病例中尤為常見,對腫瘤特性的準確解釋和臨床治療選擇帶來了巨大的挑戰。不同HER2表達的腫瘤細胞之間的轉變可以是獨立/中斷的,也可以是連續的模式(圖1)。同時進行的ISH檢測對於最終決定如何將陽性病例與陰性病例區分開來至關重要,圖1中兩個代表性病例就說明了這一點。
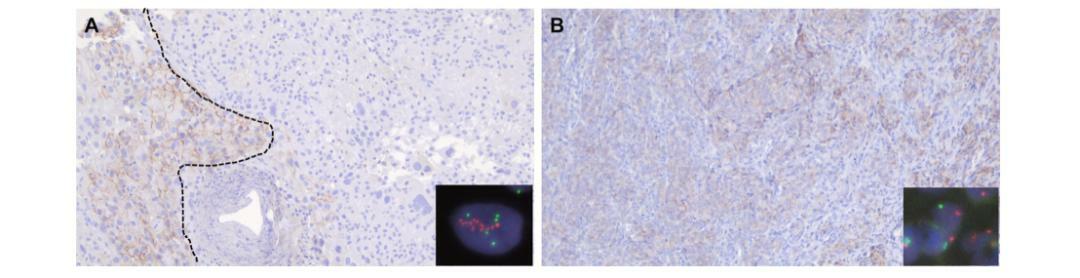
圖1.HER2異質性舉例。浸潤性乳腺癌中HER2免疫組化在同一腫瘤中的異質性表達模式的代表圖像。A)一個樣本有兩個不同的腫瘤細胞群,虛線左邊是HER2 2+細胞,右邊是HER2 0-1+細胞。通過FISH檢測到HER2 2+細胞中的HER2擴增(插圖,紅色區域。紅色:HER2,綠色。CEP17。HER2/CEP17比值:2.84,HER2拷貝數/細胞:11.80)。根據2018年ASCO/CAP指南,該病例被認為是HER2陽性。B)腫瘤細胞的樣本顯示HER2表達的連續性(從左到右,1+到2+)。通過FISH沒有檢測到HER2擴增(插圖,紅色區域。紅色:HER2,綠色。CEP17。HER2/CEP17比值:1.22,HER2拷貝數/細胞:2.40)。根據2018年ASCO/CAP指南,該病例被認為是HER2陰性。
HER2異質性還可能表現為:1)"集群"型,有兩個不同的腫瘤細胞克隆,一個是HER2擴增,另一個是HER2狀態正常;2)"嵌合"型,表現為不同HER2狀態的細胞瀰漫性交融;3)"散在型",由HER2陰性腫瘤細胞群中孤立的HER2擴增細胞組成[10]。也有報導稱,在HER2異質性腫瘤中觀察到17號染色體中心點(CEP17)的拷貝數增加,這表明染色體不穩定可能是HER2異質性的一個潛在原因[11]。
基因表達分析有助於加深對乳腺癌異質性的理解,臨床上適用的乳腺癌PAM50分型,通過檢測腫瘤組織中乳腺癌相關的50個基因的表達量從而對乳腺癌進行分型並預測復發風險,識別的主要內在亞型包括Luminal A、Luminal B、HER2-E和基底細胞樣型[12]。儘管HER2-E亞型確實與IHC和/或FISH確定的HER2陽性相重疊,但在HER2陽性乳腺癌中,所有四個內在亞型都同時存在。在HER2-E、Luminal B、基底細胞樣型和Luminal A亞型中,HER2陽性的可能性分別為64.6%、20.0%、14.4%和7.3%,這可能會影響抗HER2治療效果[13]。HER2-E亞型的特點通常是HER2調控基因高表達和Luminal相關基因低表達[14]。因此,HER2-E腫瘤可能具有最高程度的EGFR和/或HER2通路的激活,並可能從雙重HER2阻斷中獲益最多[15]。
既往多個研究對乳腺癌的內在亞型進行了回顧性分析,這些數據顯示,不考慮HR狀態時,與非HER2-E腫瘤相比,HER2-E腫瘤患者接受曲妥珠單抗加化療或HER2雙阻斷加化療治療後的pCR率更高。雖然HR+/HER2+/HER2-E腫瘤從化療+抗HER2治療中獲益最多,但曲妥珠單抗在HER2陽性、非HER2-E腫瘤中也表現出獲益。NSABP B-31和N9831試驗的內在亞型分析顯示,曲妥珠單抗在兩種luminal亞型中都有生存獲益。因此,內在亞型不適用於指導曲妥珠單抗在HER2陽性乳腺癌(新)輔助治療中的應用[16]。但是確定HER2-E表型的特徵是否有助於識別可能從無化療的抗HER2方案中獲益的患者,是一個值得探索的研究領域,目前正在進行專門針對HER2-E表型乳腺癌患者的臨床試驗。
抗HER2治療與HER2異質性
最初的研究報告稱,在輔助化療中加入曲妥珠單抗可減少HER2基因擴增或HER2蛋白過表達的乳腺癌患者的疾病復發和死亡,這些研究依賴於對HER2狀態的局部檢測。對參加NSABP B-31輔助治療試驗的患者標本進行的HER2中心實驗室檢測顯示,9.7%的病例既沒有HER2擴增也沒有HER2過表達。然而,這些患者似乎從聯合曲妥珠單抗中獲得了與腫瘤被中心實驗室確認為HER2陽性的患者相同的獲益(DFS的相對風險=0.34,95%CI:0.14-0.80;P=0.014)。結果表明,曲妥珠單抗輔助治療的獲益可能並不局限於IHC 3+和/或FISH陽性腫瘤患者。N9831和HERA輔助治療試驗的中心實驗室審查結果也支持這一點[17,18]。
在這個問題的推動下,NSABP B-47 III期試驗通過前瞻性地招募HER2低表達乳腺癌患者進行探索。然而,對3200名高危、原發性浸潤性HER2低表達乳腺癌女性的分析顯示,在化療中加入曲妥珠單抗並沒有改善這些女性的浸潤性無病生存期(IDFS)、遠處無復發生存期(DRFI)或OS[19]。研究結果提示曲妥珠單抗對HER2低表達乳腺癌患者無效。針對上述研究結果的差異,可能的解釋在於,腫瘤樣本內HER2的異質性,從而導致檢測結果的不一致性。
乳腺癌的HER2表達會受到化療和/或抗HER2治療的影響,導致治療前後HER2狀態的變化。在一項針對曲妥珠單抗+化療新輔助治療後有殘餘疾病的HER2陽性乳腺癌患者的研究中,三分之一的患者有HER2擴增的丟失,這與這些患者的無復發生存率更低具有相關性[20]。一項針對HER2陽性乳腺癌患者的回顧性研究(N=108)也證實,新輔助化療(NAC)後殘餘腫瘤中HER2的丟失會導致DFS和OS的惡化[21]。在日本的一項大型註冊試驗中(N=21755),在約2800名HER2陽性腫瘤患者中,601名患者(21.4%)在NAC後最終變成HER2陰性腫瘤,而在NAC後只有3.4%的HER2陰性腫瘤患者(N=9947)轉化為HER2陽性狀態[22]。在這項研究中,28%的腫瘤在新輔助治療後轉為HER2陰性的患者沒有接受曲妥珠單抗治療,而60%的腫瘤在治療後變成HER2陽性的患者接受了曲妥珠單抗治療。作者表明,使用曲妥珠單抗治療與殘餘腫瘤中失去HER2狀態的機率增加有關。最近,在PAMELA試驗中,對拉帕替尼+曲妥珠單抗新輔助治療前後的HER2富集(HER2-E)腫瘤進行了基因表達分析以檢測治療的早期分子改變。與基線相比,在第14天時,luminal A表型增加,細胞增殖、HER2-E和luminal B表型相對減少。這些轉變在HR+/HER2+亞組與HR-/HER2+腫瘤中更為明顯,從HER2-E到luminal A亞型的轉變與pCR率的降低有關[23]。在CALGB 40601、NeoSphere和NSABP B-41新輔助治療試驗中,也觀察到30-67%的病例在殘餘疾病中從HER2-E轉變為luminal A亞型的類似情況[23]。新輔助治療後未達到pCR與HER2陽性乳腺癌的無事件生存期(EFS)和OS不佳有關[24]。因此,這些數據意味著luminal A亞型可能預測抗HER2治療獲益不佳。
在一項預先設定的探索性分析中,對參加KATHERINE輔助治療研究的患者的殘餘疾病進行了HER2表達的檢測。高HER2基因表達與曲妥珠單抗治療組的預後較差有關,表明這些患者在新輔助抗HER2治療後存在HER2耐藥性[25]。另一方面,在T-DM1治療組中,基於HER2基因高表達與低表達的結果未觀察到這種差異,也許表明T-DM1有能力克服這些耐藥機制。
T-DM1是HER2陽性轉移性乳腺癌患者的標準二線治療方案;但有數據表明,對接受過曲妥珠單抗+帕妥珠單抗治療的患者,T-DM1療效有所降低[26,17],這可能是因為HER2在細胞膜上的表達減少,從而限制了T-DM1與腫瘤細胞的結合。在一項針對約370名HER2陽性轉移性乳腺癌患者進行的平行、回顧性、觀察性研究中,既往接受過曲妥珠單抗+帕妥珠單抗,二線使用T-DM1治療的患者的中位OS為52個月,而既往未接受過帕妥珠單抗患者的OS為74個月(P=0.0006)[28]。
因此,腫瘤抗HER2治療後HER2表達的變化以及這種變化對預後的重大影響,提示有必要對患者NAC後的殘留疾病和轉移性疾病的活檢樣本中的HER2狀態進行重新評估。
HER2異質性的啟示
HER2的異質性會影響乳腺癌患者的臨床結局。有研究表明,HER2異質性的腫瘤往往與更大的體積、更高腫瘤等級、以及淋巴結陽性有關,這些都提示著不良的預後。多項研究也顯示,HER2異質性的存在與較短的DFS和OS相關。
最近的一項2期試驗評估了HER2異質性對HER2陽性乳腺癌患者使用T-DM1+帕妥珠單抗(T+P)新輔助治療的影響。對兩個空間上彼此分隔的腫瘤進行空芯針活檢並評估HER2異質性,以檢驗區域的差異是否存在不同的HER2過表達模式。10%的患者(n=16/157)發現了HER2異質性(該試驗定義為5-50%的腫瘤細胞經FISH檢測為HER2陽性,或在多個活檢中檢測為HER2的腫瘤區域),其中81%的病例(n=13/16)同時存在HR陽性[29]。該試驗達到了其主要終點,表明HER2異質性與雙重抗HER2治療(T+P)後未達到pCR之間存在顯著關聯。10名HER2異質性患者無一達到pCR,而55%不屬於HER2異質性的患者獲得了pCR(P<0.0001)。經ER狀態和HER2 IHC狀態調整後,HER2異質性與未達到pCR之間的關聯仍然顯著。這些數據意味著HER2異質性腫瘤可能對T-DM1+帕妥珠單抗治療的應答較差。對腫瘤內空間異質性的細化分析表明,HER2非擴增細胞的整體腫瘤部分是造成治療反應不佳的原因,而不是HER2非擴增細胞比例高的單一病灶區域。
在入組了444名患者的KRISTINE新輔助治療試驗中,被分配到T-DM1+帕妥珠單抗的患者的局部區域復發率為6.7%,而被分配到TCHP組的患者為0%[30]。這是因為隨機分配到T-DM1組的患者的HER2異質性更高,這支持了HER2異質性可能導致耐藥性的觀點。此外,KRISTINE試驗的一項回顧性生物標誌物分析也顯示,與HER2染色較均勻的患者相比,HER2 IHC局灶性或複雜染色組的pCR率在兩組中都較低[31]。
腫瘤內的HER2 mRNA和蛋白水平也會影響抗HER2治療的療效。EMILIA研究的生物標誌物分析表明,HER2 mRNA水平較高相較於mRNA水平較低的HER2陽性轉移性乳腺癌患者,T-DM1的活性明顯更高(OS分別為34.1個月與26.5個月)[32]。在I-SPY2試驗中,使用反相蛋白晶片(RPPA)研究了HER2蛋白水平作為預測T-DM1+帕妥珠單抗新輔助治療的應答,結果顯示,在通過中心IHC和FISH檢測確定為HER2陽性腫瘤的患者中,HER2蛋白的定量測量與T-DM1+帕妥珠單抗的反應呈正相關。在這些HER2陽性乳腺癌患者中,總HER2和磷酸HER2 Y1248的較低定量測量與未達到pCR有關。此外,在I-SPY2試驗中,對抗HER2療法的多個治療組的分析表明,這些藥物在HER2陽性/IHC評分較低的亞組人群中效果較差[33]。
自發現HER2是一種原癌基因以及認識到HER2過度表達預示著乳腺癌的不良預後以來,迄今已經過去了三十多年的時間。從1998年首次批准曲妥珠單抗到現在,臨床中已有多種靶向HER2的藥物,包括單克隆抗體、酪氨酸激酶抑制劑和ADC藥物等。抗HER2靶向藥物在腫瘤細胞中的活性閾值最初是根據曲妥珠單抗的療效來定義的,直到新型ADC藥物問世,得益於旁觀者效應,在目標靶蛋白表達較少的情況下同樣能發揮顯著抗腫瘤活性,由此改寫了僅HER2陽性乳腺癌才能從抗HER2靶向治療中獲益的傳統局面。在這種背景下,繼續探索HER2低表達乳腺癌的臨床病理學和分子生物學特徵顯得尤為重要,這就需要更多地關注包括從0、1+、2+、3+的IHC連續譜中HER2表達的病理評估,並精準定義HER2不同表達狀態。此外,在患者的治療過程中,HER2生物標誌物的表達並不是一成不變的,這對患者預後和治療方案的選擇都產生著重要影響。因此,復發轉移乳腺癌患者重新評估HER2表達狀態至關重要。進一步研究利用基因表達譜來確定抗HER2療法的預測性生物標誌物也可能有助於優化治療。同時,考慮到腫瘤中存在的HER2異質性可能導致對傳統抗HER2療法的反應減弱。目前有必要對能夠前瞻性地識別腫瘤中HER2異質性以適當地調整治療方案的技術進行驗證。同時,開發出針對HER2表達不均勻腫瘤的有效新藥應該是未來的一個研究重點。
參考文獻:
[1]Hamilton E,Shastry M,Shiller SM,et al.Targeting HER2 heterogeneity in breast cancer.Cancer Treat Rev.2021 Nov;100:102286.
[2]King CR,Kraus MH,Aaronson SA.Amplifcation of a novel v-erbB-related gene in a human mammary carcinoma.Science 1985;229:974–6.
[3]Slamon DJ,et al.Human breast cancer:correlation of relapse and survival with amplifcation of the HER-2/neuoncogene.Science 1987;235:177–82.
[4]Eiger D,et al.The Exciting New Field of HER2-Low Breast Cancer Treatment.Cancers 2021;13:1015.
[5]Agostinetto E,et al.HER2-Low Breast Cancer:Molecular Characteristics and Prognosis.Cancers 2021;13:2824.
[6]Allison KH,Dintzis SM,Schmidt RA.Frequency of HER2 heterogeneity byfluorescence in situ hybridization according to CAP expert panel recommendations:time for a new look at how to report heterogeneity.Am J Clin Pathol 2011;136:864–71.
[7]Ohlschlegel C,et al.HER2 genetic heterogeneity in breast carcinoma.J Clin Pathol 2011;64:1112–6.
[8]Seol H,et al.Intratumoral heterogeneity of HER2 gene amplifcation in breast cancer:its clinicopathological signifcance.Mod Pathol 2012;25:938–48.
[9]Lee HJ,et al.HER2 heterogeneity affects trastuzumab responses and survival in patients with HER2-positive metastatic breast cancer.Am J Clin Pathol 2014;142:755–66.
[10]Hanna WM,et al.HER2 in situ hybridization in breast cancer:clinical implications of polysomy 17 and genetic heterogeneity.Mod Pathol 2014;27:4–18.
[11]Kurozumi S,et al.HER2 intratumoral heterogeneity analyses by concurrent HER2 gene and protein assessment for the prognosis of HER2 negative invasive breast cancer patients.Breast Cancer Res Treat 2016;158:99–111.
[12]Parker JS,et al.Supervised Risk Predictor of Breast Cancer Based on Intrinsic Subtypes.J Clin Oncol 2009;27(8):1160–7.
[13]Prat A,et al.Molecular Features and Survival Outcomes of the Intrinsic Subtypes Within HER2-Positive Breast Cancer.JNCI.J Natl Cancer Inst 2014;106(8):dju152.
[14]Prat A,Perou CM.Deconstructing the molecular portraits of breast cancer.Mol Oncol 2011;5(1):5–23.
[15]Llombart-Cussac A,et al.HER2-enriched subtype as a predictor of pathological complete response following trastuzumab and lapatinib without chemotherapy in early-stage HER2-positive breast cancer(PAMELA):an open-label,single-group,multicentre,phase 2 trial.Lancet Oncol 2017;18:545–54.
[16]Cejalvo JM,et al.Clinical implications of the non-luminal intrinsic subtypes in hormone receptor-positive breast cancer.Cancer Treat Rev 2018;67:63–70.
[17]Perez EA,et al.HER2 and chromosome 17 effect on patient outcome in the N9831 adjuvant trastuzumab trial.J Clin Oncol 2010 Oct 1;28(28):4307–15.
[18]Dowsett M,et al.Disease-free survival according to degree of HER2 Amplifcation for patients treated with adjuvant chemotherapy with or without 1 year of trastuzumab:the HERA trial.J Clin Oncol 2009;27(18):2962–9.
[19]Fehrenbacher L,et al.NSABP B-47/NRG Oncology Phase III Randomized Trial Comparing Adjuvant Chemotherapy With or Without Trastuzumab in High-Risk Invasive Breast Cancer Negative for HER2 by FISH and With IHC 1+or 2.J Clin Oncol 2020 Feb 10;38(5):444–53.
[20]Mittendorf EA,et al.Loss of HER2 amplifcation following trastuzumab-based neoadjuvant systemic therapy and survival outcomes.Clin Cancer Res 2009;15:7381–8.
[21]Branco FP,et al.Loss of HER2 and disease prognosis after neoadjuvant treatment of HER2+breast cancer.Am J Transl Res.2019 Sep 15;11(9):6110-16.PMID:31632579;PMCID:PMC6789273.
[22]Niikura N,et al.Changes in tumor expression of HER2 and hormone receptors status after neoadjuvant chemotherapy in 21,755 patients from the Japanese breast cancer registry.Ann Oncol 2016 Mar;27(3):480–7.
[23]Braso-Maristany´F,et al.Phenotypic changes of HER2-positive breast cancer during and after dual HER2 blockade.Nat Commun 2020 Jan 20;11(1):385.
[24]Cortazar P,Zhang L,et al.Pathological complete response and long-term clinical beneft in breast cancer:the CTNeoBC pooled analysis.Lancet 2014;384(9938):164–72.
[25]Denkert C,et al.Biomarker data from KATHERINE:a phase III study of adjuvant trastuzumab emtansine(T-DM1)versus trastuzumab(H)in patients with residual invasive disease after neoadjuvant therapy for HER2-positive breast cancer[abstract].J Clin Oncol 2020;38(15_Suppl):502.
[26]Dzimitrowicz H,et al.T-DM1 activity in metastatic human epidermal growth factor receptor 2–positive breast cancers that received prior therapy with Trastuzumab and Pertuzumab.J Clin Oncol 2016;34:3511–7.
[27]Vici P,Pizzuti L,et al.A retrospective multicentric observational study of trastuzumab emtansine in HER2 positive metastatic breast cancer:a real-world experience.Oncotarget 2017;8:56921–31.
[28]Bon G,Pizzuti L,Laquintana V,Loria R,Porru M,Marchio`C,et al.Loss of HER2 and decreased T-DM1 effcacy in HER2 positive advanced breast cancer treated with dual HER2 blockade:the SePHER Study.J Exp Clin Cancer Res 2020 Dec 10;39(1):279.
[29]Metzger Filho O,et al.Impact of HER2 heterogeneity on treatment response of early-stage HER2-positive breast cancer:phase II neoadjuvant clinical trial of T-DM1 combined with pertuzumab.Cancer Discov 2021 May 3:candisc.1557.2020.https://doi.org/10.1158/2159-8290.CD-20-1557.
[30]Hurvitz SA,et al.Neoadjuvant Trastuzumab Emtansine and Pertuzumab in Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer:Three-Year Outcomes From the Phase III KRISTINE Study.J Clin Oncol 2019 Sep 1;37(25):2206–16.
[31]de Haas SL,et al.Biomarker analysis from the neoadjuvant KRISTINE study in HER2-positive early breast cancer(EBC)[abstract].In:Proceedings of the 2016 San Antonio Breast Cancer Symposium;2016 Dec 6-10;San Antonio,TX.Philadelphia(PA):AACR;Cancer Res 2017;77(4 Suppl):Abstract nr P6-07-09.
[32]Baselga J,et al.Relationship between Tumor Biomarkers and Effcacy in EMILIA,a Phase III Study of Trastuzumab Emtansine in HER2-Positive Metastatic Breast Cancer.Clin Cancer Res.2016 Aug 1;22(15):3755-63.2016 Feb 26.Erratum in:Clin Cancer Res.2018 Nov 1;24(21):5486.
[33]Wulfkuhle JD,et al.HER family protein expression and activation predicts response to combination T-DM1/pertuzumab in HER2+patients in the I-SPY 2 TRIAL.J Clin Oncol 37,2019(suppl;abstr 3133).10.1200/JCO.2019.37.15_suppl.3133.
審批編號:CN-105963 過期日期:2023-12-28
*本文由阿斯利康提供支持,僅供醫療專業人士參考
*此文僅用於向醫學人士提供科學信息,不代表本平台觀點