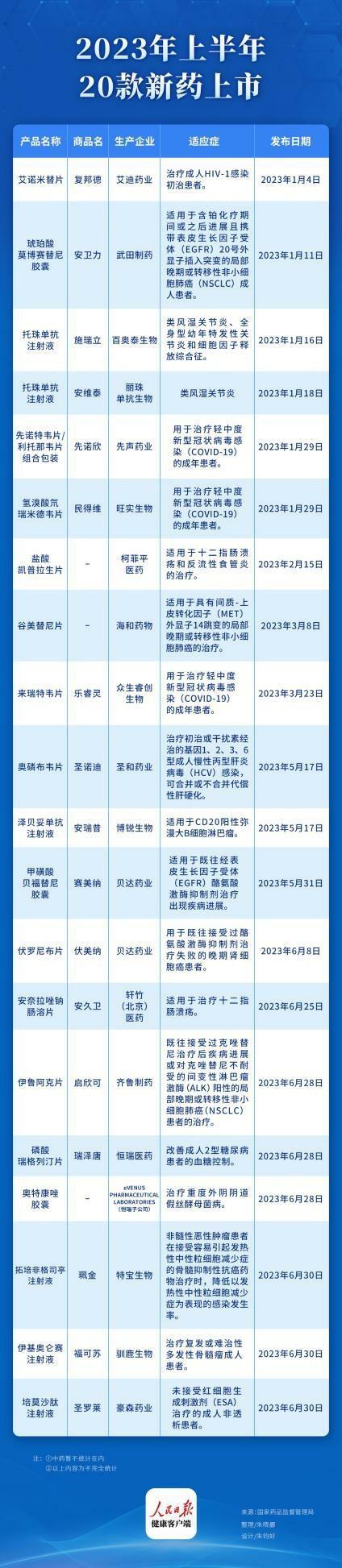
(人民日報健康客戶端 劉穎琪)據人民日報健康客戶端不完全統計,截至6月30日,2023年上半年,我國新獲批藥物(不包括中成藥與疫苗)20款,覆蓋腫瘤、抗感染、罕見病等多個領域,其中腫瘤類藥物最多,其次為罕見病藥物。對此,多位專家表示:新藥獲批再創新高,一方面基於臨床需求的旺盛,另一方面則是由於經歷過兩年監管環境的保守和觀望期,既往新藥的集中獲批。
上海醫藥集團新藥註冊與臨床研發部註冊副總監王海燕7月3日在接受人民日報健康客戶端採訪時指出,2022年國家藥監局共批准上市創新藥共計49個,首次超過美國。一批Biotech企業於2021-2022年迎來了首款上市產品,標誌著我國創新藥已經步入密集收穫期。從2023年上半年獲批的創新藥數量看,未來上市創新藥數量將迎來更快速的增長。她指出,在獲批的新藥中,腫瘤領域一直是新藥研發的重點領域,從2016年開始,抗腫瘤藥每年占比均超過50%,2023年上半年獲批的新藥仍以抗腫瘤產品居多。
而獲批新藥數量排在第二位的為罕見病用藥。蔻德罕見病中心高級顧問李楊陽告訴人民日報健康客戶端:「今年目前獲批的很多罕見病新藥,大多在2021年就已提交了新藥申請,經過了兩年我國監管環境的保守和觀望期,這些新藥終於獲批上市。」
她表示,由於2020年底以後我國就沒有再發布「臨床急需新藥名單」,很多罕見病新藥無法再像以前一樣通過這個「臨床急需」加速上市。2018年5月至今,罕見病目錄也沒有更新,也導致很多罕見病新藥因為目錄問題,暫時無法享受罕見病待遇。因此,2023年上半年獲批的罕見病藥物,可以稱之為是「遲到的結果」。
李楊陽指出,從2023年第一季度開始,真切感受到了國家藥監局對於新藥批准逐步重新回到以往的節奏,就罕見病領域,綜合臨床需求及既往新藥上市申請的累計,有望有更多藥物獲批上市,「從某種程度上說,可以理解為過去兩年間『既往作業』的交付。」
此外,近年來,隨著國內創新藥研發實力的快速提升,加上新藥審批審評提速,國產創新藥上市的數量不斷增長。在上半年批准數量創新高的同時,下半年還有不少國產創新藥有望迎來收穫期。
據人民日報健康客戶端不完全統計,在目前處於上市審評審批階段的國產1類新藥中,有26款是2022年12月31日前申報上市的。根據審評審批時限分析,如進展順利,包括南京馴鹿醫療、石藥集團、鞍石生物、科濟藥業、合源生物、愛科百發、傳奇生物等7家公司的已被納入優先審評的創新藥在內的20餘款藥物有望在下半年獲批上市。
「從製藥大國到製藥強國跨越、從以仿製藥為主向創新藥引領跨越、從高速增長向高質量發展跨越、從工業時代監管向資訊時代監管跨越的偉大進程中,創新、轉型與超越是我們這個時代藥品監管最鮮明的特徵。強化基礎研究及成果轉化、關注國際生物醫藥研究前沿熱點、營造政產學研全鏈條原始創新研發環境、完善我國藥物創新體系定位和布局、引導差異化創新,是加強我國新藥研發原始創新、推動我國創新引領醫藥行業高質量發展的重要保障。」王海燕總結道。