來源:博藥公眾號
2023年6月2日至6日(當地時間),2023年美國臨床腫瘤學會 (American Society of Clinical Oncology,ASCO) 在美國伊利諾州芝加哥以線上線下混合會議形式舉辦。
ASCO年會每年一次,是全球腫瘤領域權威的學術交流盛會,今年(2023年)ASCO年會的主題為「與患者合作:癌症治療與研究的基石(Partnering With Patients: The Cornerstone of Cancer Care and Research)」,會上相關單位以口頭報告和壁報展示等形式發布多項當前國際前沿的臨床腫瘤學科研成果和腫瘤治療技術關鍵研究的最新試驗數據。其中,入選ASCO口頭報告的摘要一般是不同癌症領域比較有代表性的研究,對於患者的治療具有重要意義。
以下為今年ASCO會上發布的國內創新藥企重磅創新藥/療法的最新研究盤點——
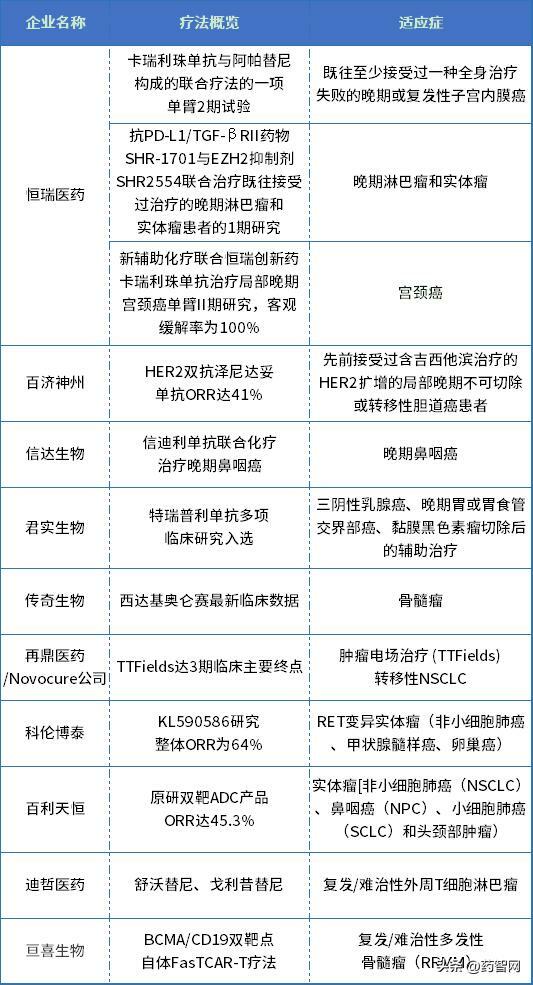
資料來源:企業公告等公開信息整理
恆瑞醫藥:兩項聯合療法亮相
恆瑞醫藥在本次ASCO大會入選了兩個口頭報告和3個壁報展示,包括卡瑞利珠單抗與阿帕替尼構成的聯合療法的一項單臂2期試驗(CAP 04研究);抗PD-L1/TGF-βRII藥物SHR-1701與EZH2抑制劑SHR2554聯合治療既往接受過治療的晚期淋巴瘤和實體瘤患者的1期研究(NCT04407741);以及新輔助化療聯合卡瑞利珠單抗治療局部晚期宮頸癌(locally advanced cervical cancer,LACC)單臂II期研究的最新數據(NACI研究)等。
CAP 04研究共納入36例受試者,既往均未接受過免疫檢查點抑制劑治療。截至2023年1月16日,中位隨訪時間為14.0個月(IQR: 6.3, 23.3),36例療效可評估人群中,確認的客觀緩解率(ORR)為44.4%(95% CI: 27.9%, 61.9%),其中2例患者達到完全緩解(CR),14例患者達到部分緩解(PR),17例患者達到疾病穩定(SD),確認的疾病控制率(DCR)為91.7%(95% CI: 77.5%,98.2%)。值得關注的是,中位至應答時間(TTR)僅為1.9個月(95% CI: 1.8, 2.5),提示「雙艾」治療晚期EC患者,可快速起效。
NCT04407741是一個開放標籤、單臂、研究者發起的劑量遞增和擴展1期研究。研究結果顯示,SHR-1701聯合SHR2554在既往接受過免疫療法的經典型霍奇金淋巴瘤(cHL)患者中顯示出可控的安全性和令人鼓舞的抗腫瘤活性,尤其是在可評估的cHL患者中,客觀緩解率達到100%。
NACI研究作為首個LACC的新輔助化療聯合免疫治療研究,結果顯示,新輔助化療聯合卡瑞利珠單抗治療局部晚期宮頸癌具有良好的抗腫瘤活性,安全性可控,尤其是在療效可評估人群中,客觀緩解率為100%。
百濟神州:HER2雙抗澤尼達妥單抗ORR達41%
百濟神州在2023 ASCO大會口頭報告了HER2雙抗澤尼達妥單抗治療既往經治的HER2擴增性膽道癌的關鍵性2b期HERIZON-BTC-01研究的結果。
HERIZON-BTC-01試驗是一項開放標籤的全球2b期研究,針對先前接受過含吉西他濱治療的HER2擴增的局部晚期不可切除或轉移性膽道癌患者。試驗一共入組了87名患者(第1組n=80;第2組n=7)。根據本次公布的數據,在HER2陽性患者中,經獨立中心審查(ICR)確認的客觀緩解率(cORR)為41%。中位反應持續時間(DOR)為12.9個月;中位研究隨訪時間為12.4個月。
信達生物:信迪利單抗聯合化療治療晚期鼻咽癌
信達生物在2023 ASCO大會口頭報告了信迪利單抗聯合誘導性化療和同步放化療(IC-CCRT)對比IC-CCRT治療局部晚期鼻咽癌的多中心III期隨機對照臨床研究(CONTINUUM)。值得一提的是,CONTINUUM研究入選了2023年ASCO的Late-Breaking Abstract(LBA)摘要(摘要號:LBA6002)。
CONTINUUM研究是第一個PD-1抑制劑聯合放化療治療局部晚期鼻咽癌的臨床試驗。研究從2018年12月到2020年3月,一共入組了425例患者,其中210例隨機到信迪利單抗組,215例隨機到標準治療組。經過42個月的中位隨訪(存活的病人中,94%隨訪時間超過36個月),意向性分析發現,信迪利單抗組的3年EFS相較於標準治療組提升了10%,顯著優於標準治療組(86.1% vs. 76.0%,分層HR 0.59,95%CI:0.38-0.92,p = 0.019)。
君實生物:特瑞普利單抗多項臨床研究入選
君實生物抗PD-1單抗特瑞普利單抗有多項臨床研究入選本次大會口頭報告,包括:1)用於可切除II/III期NSCLC圍手術期治療的3期Neotorch研究;2)治療復發或轉移性三陰性乳腺癌的3期TORCHLIGHT研究;3)治療無EGFR/ALK突變晚期NSCLC的3期CHOICE-01研究;4)治療局部晚期胃或胃食管交界部癌的2期研究;5)黏膜黑色素瘤切除後的輔助治療研究等。
其中,Neotorch研究(NCT04158440)是一項隨機、雙盲、安慰劑對照的III期臨床研究,旨在比較特瑞普利單抗或安慰劑聯合化療用於II/III期可手術NSCLC患者圍手術期治療的療效和安全性。研究共納入404例III期NSCLC患者。結果顯示,與單純化療相比,特瑞普利單抗聯合化療用於III期可手術NSCLC患者圍手術期治療並在後續進行特瑞普利單抗單藥鞏固治療,可顯著延長患者EFS經盲態獨立中心病理(BIPR)評估,特瑞普利單抗聯合化療組的主要病理緩解(MPR)率和完全病理緩解(pCR)率方面均優於單純化療組,分別為48.5% vs 8.4%(P<0.0001)和24.8% vs 1.0%(P<0.0001)。特瑞普利單抗聯合化療組的總生存期(OS)也顯示出明顯的獲益趨勢。兩組中位OS分別為未成熟 vs 30.4個月(HR=0.62,95% CI: 0.381-0.999);1年OS率和2年OS率分別為94.4% vs 89.6%和81.2% vs 74.3%。患者將繼續進行OS隨訪。
傳奇生物:西達基奧侖賽最新臨床數據
傳奇生物開展的3期CARTITUDE-4研究結果以口頭報告的形式在ASCO大會上展示,該試驗比較了西達基奧侖賽與標準治療在既往接受過1-3線治療的復發且來那度胺耐藥的多發性骨髓瘤患者中的療效。結果顯示,在中位隨訪16個月時,與標準治療方案(SOC)相比,西達基奧侖賽降低了既往接受過1-3線治療且來那度胺耐藥的多發性骨髓瘤成人患者74%的疾病進展或死亡風險。
該研究入組419名患者並隨機分配到西達基奧侖賽(n=208)和SOC(n=211)兩個治療組。研究數據顯示,在中位隨訪16個月時,SOC組的中位無進展生存期(PFS)為11.8個月,而西達基奧侖賽組中位PFS尚未達到。在既往接受過一線治療患者中,西達基奧侖賽降低了65%的疾病進展或死亡風險。在次要終點中,西達基奧侖賽組總緩解率(ORR)為85%,73%的患者達到完全緩解(CR)或更好,總體的微小殘留病(MRD)陰性率達到61%。而在接受SOC治療的患者中,ORR為67%,22%的患者達到CR或更好,MRD陰性率為33%。
再鼎醫藥/Novocure公司:TTFields達3期臨床主要終點
再鼎醫藥的合作夥伴Novocure公司在今年ASCO年會上首次公布腫瘤電場治療TTFields的3期LUNAR研究結果,並以完整口頭報告(LBA)形式展示。
LUNAR是一項開放標籤、隨機、國際多中心的3期研究,針對以鉑類為基礎治療期間或之後進展的轉移性NSCLC患者。再鼎醫藥正在參與這項研究的中國部分。
試驗結果顯示,這一研究達到了其主要終點,中位總生存期(OS)獲得顯著統計學意義和臨床意義的改善(HR=0.74,P=0.035)。在與免疫檢查點抑制劑聯用的患者組中,TTFields的療效更為明顯,可將患者死亡風險降低約37%(HR=0.63)。
科倫博泰:KL590586研究整體ORR為64%
科倫博泰下一代選擇性RET抑制劑KL590586在RET變異實體瘤患者中開展的1期研究入選了本次大會口頭報告。
該研究是一項針對 RET 基因改變的晚期實體瘤患者的 I/II 期臨床研究。截至2022年12月30日,I期劑量遞增和劑量擴展階段納入87例RET基因改變的腫瘤患者,按研究設計分配到6個劑量組(10mg-120mg,QD)接受治療。
研究中69例接受有效劑量(40mg-120mg)治療的患者療效可評估,其中57例為非小細胞肺癌(NSCLC),10例為甲狀腺髓樣癌,1例為胰腺癌,1例為卵巢癌。臨床數據顯示,69例可評估療效的患者里,整體ORR為64%。沒有觀察到劑量限制性毒性(DLT),最大耐受劑量(MTD)未達到。
百利天恆:原研雙靶ADC產品ORR達45.3%
百利天恆在會上報告了雙靶特異性抗體偶聯藥物(ADC)BL-B01D1用於實體瘤患者I期的試驗結果。結果顯示,BL-B01D1在多種重度經治的轉移性/局部晚期實體腫瘤中療效顯著。
BL-B01D1的I期臨床試驗中,總共入組195例患者,主要包含非小細胞肺癌(NSCLC)、鼻咽癌(NPC)、小細胞肺癌(SCLC)和頭頸部腫瘤一線標準治療失敗後的患者,其中50%的患者已超過三線治療。此試驗設計採用傳統「3+3」劑量爬坡,同時進行劑量擴展和劑量優化。主要終點是評估藥物在人體的初始安全性和耐受性,為後續臨床試驗探索推薦劑量和給藥方案,次要終點是評估藥物對患者的有效性和藥代動力學(PK)。
研究結果表明,患者總體客觀緩解率(ORR)達到45.3%,部分緩解(PR)率為45.3%,中位無進展生存期(PFS)暫未達到。
迪哲醫藥:舒沃替尼、戈利昔替尼
迪哲醫藥共兩項壁報入選口頭報告,分別為其EGFR-TKI舒沃替尼首個中國註冊臨床研究WU-KONG6(悟空6)和戈利昔替尼治療復發/難治性外周T細胞淋巴瘤的關鍵性註冊試驗(JACKPOT8 Part B)。
WU-KONG6是一項針對EGFR exon20插入突變的NSCLC患者的中心II期臨床研究,研究針對既往接受鉑化療失敗、進展的患者展開。數據顯示,在既往化療失敗的97例EGFR exon20ins突變型晚期NSCLC患者中,ORR達到60.8%,在多種EGFR exon20ins突變亞型中均觀察到抗腫瘤活性,對基線伴有經治且穩定的腦轉移患者也顯示出療效。
JACKPOT8 Part B既往數據顯示戈利昔替尼治療復發難治性外周T 細胞淋巴瘤ORR 達42.9%,高於目前標準療法。
亘喜生物:BCMA/CD19雙靶點自體FasTCAR-T療法
亘喜生物以口頭報告形式在2023 ASCO年會上公布了一項評估B細胞成熟抗原(BCMA)和CD19雙靶點自體FasTCAR-T療法GC012F治療復發/難治性多發性骨髓瘤(RRMM)多中心臨床研究的長期隨訪數據。
GC012F的這項單臂、開放性、多中心的由研究者發起的臨床試驗(IIT)共計入組並治療了29例RRMM患者。截至2023年4月12日數據截止日,中位隨訪時間為30.7個月(範圍:14.6 - 43.6個月)。患者在接受了GC012F治療後取得如下臨床數據:總體應答率(ORR)為93.1%(27/29),其中89.6%(26/29)的患者達到非常好的部分緩解(VGPR)及以上的療效;82.8%(24/29)的患者達到MRD- sCR;100%(29/29)的患者達到MRD陰性。
小結
近年來,中國醫藥生物行業創新能力逐漸增強,越來越多的中國藥企在海外展露光芒。除了ASCO,還有JPM、ESMO等,中國的創新藥的展示的機會也逐漸增多。在這些會議上,中外企業積極交流學術進展的同時,還暗藏著投資交易的機會。此前,一些國內重磅license out的出海交易也正是得益於海外會議的舞台。相信未來,將有更多的國產創新藥站上國際舞台。
作者: cookie
聲明:本文系藥智網轉載內容,圖片、文字版權歸原作者所有,轉載目的在於傳遞更多信息,並不代表藥智網立場。如涉及作品內容、版權和其它問題,請在本平台留言,我們將在第一時間刪除。