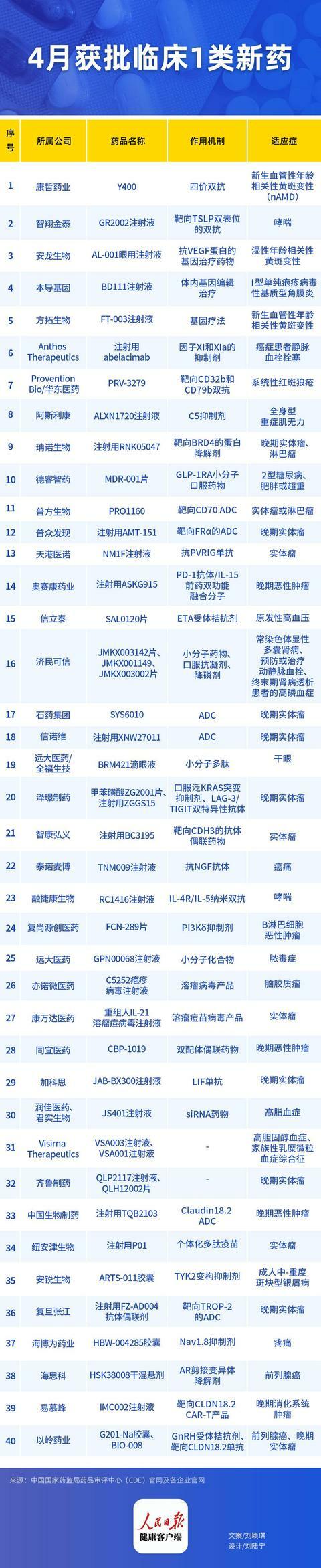
(人民日報健康客戶端 劉穎琪)據人民日報健康客戶端不完全統計,根據國家藥監局藥品審評中心(CDE)官網數據,4月有約46款1類新藥獲批臨床,其中多款為首次在我國獲批。
阿斯利康C5抑制劑,患者可自我給藥
據國家藥監局藥品審評中心官網顯示,4月22日,阿斯利康ALXN1720注射液臨床試驗申請通過CDE「默示許可」。據阿斯利康官網信息,ALXN1720注射液是一款第三代C5抑制劑,該產品是全球唯一一款抗C5/albumin雙抗。此次獲批是首次在國內獲批。
ALXN1720注射液是一款雙特異性迷你抗體,有望成為一款每周一次,由患者自我給藥的皮下注射療法,大幅度提高患者接受治療的便捷程度。ALXN1720正在海外開展治療全身型重症肌無力的3期臨床研究,本次它在中國獲批臨床,擬開發治療全身型重症肌無力。
普方生物PRO1160擬開發治療實體瘤或淋巴瘤患者
4月20日,CDE官網顯示,普方生物注射用PRO1160獲批臨床,為首次在中國獲批臨床,用於治療實體瘤或淋巴瘤患者。1月3日,普方生物曾宣布其ADC藥物PRO1160的臨床試驗申請已獲得美國食品藥品監督管理局(FDA)的批准。
據普方生物官網信息,PRO1160是一種靶向CD70的抗體偶聯藥物(ADC)產品,由CD70單抗、可切割親水性連接體和拓撲異構酶1抑制劑exatecan組成。根據早先在美國癌症研究協會(AACR)上發表的臨床前數據,PRO1160在體內和體外均顯示出較好的抗腫瘤活性。在腎細胞癌和非霍奇金淋巴瘤小鼠模型中顯示有效的腫瘤生長抑制作用,且數據顯示該產品具有較寬的治療窗,有擴大治療指數的潛力。該產品本次獲批臨床,擬開發治療實體瘤或淋巴瘤患者。
遠大醫藥/全福生技小分子多肽,用於治療乾眼
4月18日,遠大醫藥(00512)發布公告,集團用於治療乾眼症的小分子多肽藥物GPN00136(BRM421)的II期臨床試驗申請,已獲得國家藥品監督管理局臨床試驗默示許可,也是首次在國內獲批。
據其官網信息顯示,GPN00136(BRM421)為創新小分子多肽滴眼液產品,通過加速角膜緣幹細胞的分裂增殖,促進眼表修復以治療乾眼。遠大醫藥獲得全福生技(BRIM Biotechnology)授予開發及商業化該產品的權利。該產品已於美國完成的II期臨床研究數據顯示,與目前已上市的治療乾眼的環孢素類滴眼液相比,其安全性高且刺激性小,具有能夠在兩周內迅速緩解乾眼症症狀和體徵的潛力。