NEJM醫學前沿
在某種意義上,乳腺癌輔助治療與新輔助治療臨床試驗引領了惡性腫瘤治療的研究方向。在後基因組時代,早期乳腺癌全身治療臨床試驗面臨新的挑戰與機遇,我們在此綜合NEJM、Nat Rev Clin Oncol、Nat Med、CA Cancer J Clin等雜誌文章,梳理從前基因組時代到後基因組時代乳腺癌全身治療臨床研究的演變,以期為讀者開展乳腺癌臨床研究提供參考,甚至為其他腫瘤臨床研究提供啟發。
乳腺癌癌治療演變
近半個世紀以來,乳腺癌治療模式變化顯著,其從根治手術轉變為局部治療和全身治療相結合的方式,得益於多學科綜合管理和化療、內分泌治療、靶向治療及免疫治療的進展,乳腺癌患者生存結局也隨之顯著改善。乳腺癌治療模式演變根源在於人們對其生物學特性認識不斷完善,並據此開發針對性的治療方案。
首先,淋巴結轉移患者復發風險較高,而全身輔助化療有助於改善預後;之後人們發現約三分之二乳腺癌患者為激素受體(HR)陽性,通過多種內分泌療法抑制雌激素受體(ER)信號傳導可使患者獲益;第三,乳腺癌多種基因異常與腫瘤發生發展密切相關,並可能成為治療靶點。
在早期乳腺癌患者中開展的首批大型輔助治療研究重點是輔助化療;當時的研究採用非隨機設計,或對化療、觀察或安慰劑進行比較。根據這些開創性研究結果,人們隨後發起了國家乳腺和腸道外科輔助治療項目(NSABP),該項試驗結果及後期大型薈萃分析均證實數種藥物聯合輔助化療可顯著降低乳腺癌復發率和死亡率(分別降低28%和16%)。
20世紀80年代初, NATO和NSABP試驗首次證實HR陽性早期乳腺癌患者接受他莫昔芬輔助治療有臨床獲益。之後,早期乳腺癌臨床試驗協作組(EBCTCG)匯總3萬名患者生存結局數據,進一步證實他莫西芬與疾病復發率和死亡率均顯著降低(分別為25%和17%)。HR陽性乳腺癌患者輔助內分泌治療由此成為個體化治療的第一步。
針對HER2陽性乳腺癌患者的HER2靶向療法的出現,是乳腺癌個體化治療演變的另一個里程碑。HERA試驗表明,輔助化療後使用曲妥珠單抗1年,10年無病生存(DFS)獲益率達6%~8%。
輔助治療試驗的演變
早期乳腺癌第一批開創性臨床試驗僅對試驗治療方案與觀察或安慰劑進行比較;第二批研究則更為複雜和精細,開始對不同干預措施療效差異進行比較,包括不同化療方案(如蒽環類和蒽環類聯合紫杉類藥物)、不同內分泌治療藥物(如他莫西芬和芳香化酶抑制劑)及不同靶向治療策略(如單一和雙重HER2抑制)。由於治療收益差異有限,當樣本量較小時,差異有可能檢測不到,因此必需通過定期薈萃分析才能證實這些微小但顯著的風險差異:例如,基於蒽環類藥物的化療方案聯合紫杉醇類藥物可使淋巴結陽性乳腺癌患者8年疾病復發率降低4.6%,8年乳腺癌死亡率降低2.8%,全因死亡率降低3.2%。
第二批研究使人們意識到大樣本量的重要性,但試驗成本呈指數增長,而且也不能保證試驗一定成功,D-care、BEATRICE和ALTTO等均是大型隨機試驗,但並未觀察到試驗組患者有統計學意義的生存獲益。
新輔助治療興起
新輔助治療最初用於局部晚期或不能手術患者,期望在術前通過全身治療降低腫瘤負荷增加手術機會。隨著保乳手術廣泛開展,新輔助治療有利於提高保乳手術機率。但NSABP-B18試驗證實,採用阿黴素+環磷醯胺新輔助或輔助治療的DFS和總生存期(OS)均無顯著差異,因而人們對新輔助治療試驗興趣銳減。
新輔助治療可以通過測量靶病灶直徑快速、直觀評估療效,並比較治療前、治療期間和治療後腫瘤生物學的變化,經過長期研究,新輔助治療試驗的終點確定為病理學完全緩解(pCR),以作為長期預後指標替代終點。隨著美國食品藥品管理局(FDA)認可pCR作為新藥加速批准的替代終點,新輔助治療試驗再次活躍。
但pCR與OS之間的關係存在爭議。2014年,FDA資助的一項薈萃分析僅在患者水平證實pCR與OS之間存在相關性,但在試驗水平上二者缺乏關聯,因此有人開始質疑pCR作為新輔助臨床試驗主要終點的合理性。臨床研究進入到後基因組時代以及免疫治療時代後,新輔助治療臨床試驗仍然廣泛開展,但最佳終點存在爭議。
後基因組時代的新輔助治療臨床試驗
在人類基因組計劃的完成後的後基因組時代,對DNA、RNA和蛋白質測序數據分析是當今生物醫學研究重要組成部分,也為乳腺癌新輔助治療臨床試驗提供了新思路。前基因組時代新輔助治療研究重點是確定藥物療效、預測其成功概率或者調整給藥方案。新輔助治療臨床試驗特點是「產生假設」,隨後通過大型研究驗證這些假設。前基因組時代新輔助試驗解決了重要臨床問題,例如多西他賽+阿黴素優於阿黴素,紫杉醇周療優於3周療法,芳香化酶抑制劑優於他莫西芬等;然而這些研究未能找到有效的生物標誌物。
後基因組時代的新輔助試驗有助於判斷新藥物療效是否值得在輔助治療試驗中進一步研究。例如,根據NeoSphere試驗中帕妥珠單抗聯合曲妥珠單抗新輔助治療HER2+乳腺癌可顯著提高篇CR率,該方案獲得FDA加速批准;後來更大樣本量(n=4805)的輔助治療試驗APHINITY證實了該療法的有效性。
KEYNOTE-522試驗則標誌著新輔助治療試驗進入免疫治療時代。這項大型(n=1,174)3期試驗證實帕博利珠單抗聯合化療新輔助治療高危早期三陰性乳腺癌(TNBC),兩項主要終點pCR和無病生存期(EFS)均顯著改善(參見《哪種預後標誌物適合早期三陰性乳腺癌 | KEYNOTE-522的啟示》)。該項試驗還提示,pCR改善並不是生存結局的可靠替代指標;後基因組時代的新輔助治療試驗還有助於深入剖析腫瘤生物學特徵及尋找有臨床價值的生物標誌物。
尋找生物標誌物
HR+/HER2-乳腺癌。對於這部分患者,Ki-67水平或許有助於預測新輔助內分泌治療的預後。兩項小型新輔助試驗IMPACT和Z1031數據顯示,新輔助內分泌治療後2~4周的Ki-67比基線Ki-67能更好預測患者臨床結局。POETIC研究納入4480例HR+/HER2-早期乳腺癌患者,在手術前14天隨機接受芳香化酶抑制劑或安慰劑治療,結果發現,基線時Ki-67水平<10%或經過2周治療後Ki-67對患者疾病復發風險降低更多,提示動態檢測Ki-67水平可以幫助篩選出可能無需治療升級的患者。對於Ki-67無應答患者,治療升級獲益可能性較低,例如Z1031試驗顯示,接受短期內分泌治療未獲得Ki-67應答的患者後續接受化療,pCR率未見提高。
術前內分泌預後指數(PEPI)也有助於篩選出需要治療升級的患者。PEPI根據新輔助內分泌治療後腫瘤大小、淋巴結狀態、ER狀態和 Ki-67陽性率評估,IMPACT試驗證實PEPI評分可成功預測患者無復發生存結局。
在接受內分泌治療患者中,根據基因表達特徵可以篩選出適合治療降級人群。MammaPrint和Oncotype-DX基因檢測可以篩選出僅使用內分泌治療就能獲得較佳臨床結局的患者(參見《乳腺癌21基因再發NEJM:落霞與孤鶩齊飛,秋水共長天一色|吳炅點評》) 。腫瘤亞型也可以作為預測的生物標誌物,例如3期MONALEESA試驗顯示基底樣亞型以外的所有PAM50亞型都可以從內分泌+CDK4/6抑制劑瑞博西利治療獲益。
HER2陽性乳腺癌。此型乳腺癌生物標誌物研究集中在HER2本身(如ERBB2拷貝數和CEP17比值、多體性、mRNA和蛋白表達)或其他受體/配體(如 HER3,EGFR,EGF,IGFR),HER2下游信號通路(例如PIK3CA/PTEN 或 RhoA),但尚未證實這些生物標誌物臨床效用。
腫瘤內在亞型(tumor-intrinsic subtypes)可以指導患者治療升級或降級。在基於PAM50的乳腺癌分型中,HER2過表達型在新輔助治療後pCR可能性更高。結合臨床、病理和分子特徵以更好預測早期HER2+乳腺癌患者臨床結局的工具正在開發中。
DECRESCENDO(NCT04675827)是一項正在進行的單臂前瞻性試驗,目的是了解HER2陽性、HR陰性和淋巴結陰性早期乳腺癌患者接受化療降級的結局。在紫杉類化療+雙重HER2阻斷治療後,獲得pCR患者繼續接受14周期帕妥珠單抗+曲妥珠單抗,但不再化療。這種治療策略基於如下假設:HER2過表達亞型具有「HER2成癮」特性,適宜避免蒽環類藥物化療。該試驗設計要求必須證明3年無復發生存率至少達94%,才能達到主要終點。
三陰性乳腺癌(TNBC)。長期以來,TNBC缺乏有效靶向治療藥物,化療一直是唯一有效治療方法。但近年來,TNBC治療取得長足進步,包括PARP抑制劑、免疫檢查點抑制劑和抗體偶聯藥物等均顯著改善了TNBC預後。
雖然免疫治療TNBC顯示出良好前景,但迄今為止,PD-L1表達水平、腫瘤浸潤淋巴細胞(TILs)、腫瘤突變負荷、錯配修復缺陷、免疫基因特徵和腫瘤分子亞型等生物標誌物均無法預測早期TNBC對免疫檢查點抑制劑的應答。
一部分傳統上的TNBC屬於HER2低表達腫瘤(即HER2免疫組化評分為1+或2+,但FISH未檢測到基因擴增)。3期DESTINY-Breast04試驗證實,與醫生選擇的化療相比,抗體偶聯藥物T-DXd顯著延長患者中位無進展生存期(PFS)和OS(參見《NEJM重磅:ADC打破乳腺癌HER2陰陽二分格局,挑戰仍存 | 專家點評》)。該項試驗結果提示,乳腺癌傳統亞型分類在某種程度上可能過於簡單和無益,因為HER2和激素受體表達水平都不是二元的,而是一個連續表達譜;而且HER2異質性也需要量化評估,並明確同質性或異質性HER2低表達腫瘤的有效治療藥物。
改進試驗設計
探索更合理的替代終點。在新輔助治療試驗中,關於有效替代終點的爭議一直未能塵埃落地。理想的替代終點應該在研究水平和患者個體水平均與生存終點穩定相關。目前pCR能否作為有效替代終點仍存爭議。
在評估免疫治療藥物療效時,pCR與長期預後相關性更差。GeparNUEVO是一項隨機2 期臨床試驗,分析了新輔助化療+度伐利尤單抗治療早期TNBC患者效果,儘管pCR未見顯著提高,但中位隨訪43.7個月後,度伐利尤單抗組3年OS顯著改善(95.1% vs. 83.1%;HR,0.26;95% CI,0.09~0.79;P=0.0076)。這一結果可能反映了免疫檢查點抑制劑與細胞毒性藥物作用機制不同,免疫治療通過激活免疫應答發揮殺傷癌細胞作用而非直接殺傷癌細胞,因此,其療效更持久,並且在某些條件下,免疫治療藥物具有延遲效應。
殘餘腫瘤負荷(RCB)基於殘餘腫瘤大小、腫瘤細胞和原位癌細胞所占比例以及陽性淋巴結數量和腫瘤轉移情況進行綜合評估,根據相關參數,RCB可以分為四類,RCB 0(pCR)、RCB 1、RCB 2和 RCB 3。RCB與長期結局之間的關聯在HR+/HER2-乳腺癌、HER2+乳腺癌和TNBC中均已得到證實。在早期乳腺癌新輔助臨床試驗中,RCB越來越多地作為臨床終點(圖1)。用RCB和無事件生存期(EFS)作為臨床獲益指標替代pCR可能會提高新輔助臨床試驗數據準確性。
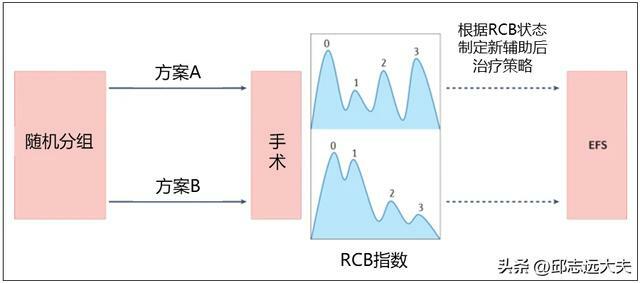
圖1. 殘餘腫瘤負荷(RCB)作為新輔助治療試驗終點
生存終點也存在爭議。FDA於2018年發布的替代終點列表中,除pCR外,還包括DFS、EFS、客觀緩解率(ORR)和無進展生存期(PFS)。使用這些替代終點初衷是希望加快審批過程,使患者更早獲得可能有效的藥物。但是,這些替代終點與OS的關係差異很大,其關聯可能很弱甚至根本無關。
新輔助治療後治療升級或降級。新輔助治療優勢之一是可以根據新輔助治療效果進行治療升級或降級。儘管pCR並不完美,但新輔助治療後未獲得pCR患者的預後通常比獲得pCR患者的長期生存結果更差,因此新輔助治療後未達到pCR的患者可能需要升級治療。新輔助治療後的方案選擇是臨床研究的沃土,因為入組患者均為殘留侵襲性病灶的高風險患者(可能需要治療升級),而且不會納入標準方案已經治癒的患者(圖2)。

圖2. 新輔助治療後的臨床試驗策略
在CREATE-X試驗中,910例新輔助化療後未達到pCR的早期HER2-乳腺癌患者隨機分配接受6~8個周期卡培他濱治療或不進行治療。全人群分析顯示,卡培他濱輔助治療顯著改善DFS和OS。在KATHERINE試驗中,1486例接受新輔助化療+曲妥珠單抗後未達pCR的HER2+早期乳腺癌患者被隨機分配接受恩美曲妥珠單抗(T-DM1)或曲妥珠單抗治療14個周期,結果表明T-DM1與DFS顯著改善相關。
通過對新輔助治療後殘留病灶的分析可以調整術後全身治療方案,即可以根據殘留病灶中Ki-67、TIL、RCB等生物標誌物情況制定治療方案,隨後進行前瞻性驗證。
此外,還可以根據新輔助治療結果選擇治療降級。例如,對沒有殘留病灶的患者可以避免乳房切除和腋窩淋巴結清掃手術(參見《如何看待這 10 個媒體熱捧的乳腺癌研究?》)。RESPECT是一項3期、非劣效性、隨機對照試驗,納入已手術的I~ⅢA期老年乳腺癌患者,評估曲妥珠單抗 vs. 曲妥珠單抗+化療的結局。兩組3年DFS無顯著差異(89.2% vs. 94.8%;P=0.35),而且曲妥珠單抗單藥治療組健康相關生活質量指標更好。由於兩組間差異很小,對於不能忍受或可能拒絕化療患者,曲妥珠單抗單藥治療是一個合理選擇。前文已述及,DECRESCENDO試驗正在進行,以了解HER2陽性、HR陰性和淋巴結陰性早期乳腺癌患者接受化療降級的結局。對於預後良好或無法耐受化療相關毒性的患者,有必要繼續嘗試降級治療和評估避免化療的方案。
未來方向
隨著基因組學、蛋白質組學、代謝組學、藥物遺傳學和功能成像等新興技術在臨床試驗的應用,早期乳腺癌的(新)輔助臨床試驗將迎來新時代。
液體活檢
作為一種無創檢測方法,液體活檢已經展示出臨床效用(參見《腫瘤液體活檢:基本概念、臨床開發原則和應用》)。
液體活檢有望先於影像學檢測出疾病復發,因此可能成為(新)輔助試驗設計中的重要工具,以篩選出需要進一步治療的患者,並最終指導新輔助治療後的治療升級或降級。有研究者在ASCO 2022年會上報告ctDNA檢測高危HR+乳腺癌患者復發數據。該項研究納入83例患者,10%通過ctDNA檢測出微小殘留病灶。在隨訪期內,所有遠處復發患者均檢測到ctDNA,從ctDNA首次檢出至臨床復發時間超過37.6個月。但在檢測到ctDNA後立即進行干預能否改善患者預後還需要更多臨床試驗來確定。
功能成像
腫瘤異質性會影響活檢價值。而SPECT或PET-CT等功能成像有助於對腫瘤狀態進行全身評估並預測治療反應。ZEPHIR試驗評估了89Zr-曲妥珠單抗(HER2-PET)和早期連續FDG-PET成像在接受T-DM1全身治療的晚期HER2陽性乳腺癌患者中的應用。結果顯示,在T-DM1治療1個周期後,HER2-PET結果陰性且疾病穩定(無放射學進展證據)或HER2-PET結果陰性且代謝進展的患者對後續治療沒有應答(陰性預測值為100%)。此外,基線HER2-PET/CT和FDG-PET/CT成像聯合應用可準確預測治療失敗時間。功能成像可以幫助腫瘤科醫生預測治療應答並相應調整治療方案,因此有必要對功能成像開展更多研究。
單細胞測序和空間轉錄組測序技術
包括乳腺組織在內的人體所有器官都由相互關聯而功能不同的細胞亞群組成。單細胞RNA測序可以識別同一組織中不同的細胞亞群。然而,單細胞測序獲得的信息不包括細胞在組織中的空間定位信息,而空間信息對於理解不同細胞之間相互作用至關重要。單細胞RNA測序技術與空間轉錄組學技術聯合可以進一步幫助確定惡性和非惡性乳腺組織之間異同,也能夠解析腫瘤間和腫瘤內異質性。
整合與合作
儘管早期乳腺癌臨床試驗協作組(EBCTCG)等學術組織試圖整合不同試驗結果,但早期乳腺癌臨床和轉化研究仍然高度割裂。生物標誌物的發現和驗證過程可能需要規模龐大、注釋良好且與臨床結局相關的「候選生物標誌物」資料庫,但是任何一項臨床試驗均無法實現這一目標。有鑑於此,國際醫學期刊編輯委員會(ICMJE)在2016年發表重要聲明,指出共享干預性臨床試驗數據是一項重要倫理義務。在智慧財產權保護期之後,從質量控制合格的試驗中獲得的生物標誌數據應當由科學界免費共享。此外,讓患者權益組織在未來試驗設計中發揮積極作用,既可以作為學術研究的基礎,也可以為工業界主導的研究提供「平衡」。
為優化資源,提高效率,並最大限度減少患者接受不令人滿意的、有時甚至是有毒治療的風險,新輔助治療試驗應首先關注「發現信號」、隨機、患者數量有限的2期試驗,並隨後在更大規模隨機3期試驗中進行證實。美國的I-SPY試驗在多年前就採用了這種策略,對早期乳腺癌患者進行新輔助治療和個性化適應性新藥評估,以確定哪些新藥對特定乳腺癌亞型最有效,並確定治療成功的早期預測因素。I-SPY2根據患者入組時的分子亞型分配試驗組,當試驗藥物預測概率達到預先指定療效或無效水平時,該藥物就會被宣布成功或停止使用。這種模式可以快速推進,從而快速評估新藥。
參考文獻
1. Burstein HJ. Systemic therapy for estrogen receptor-positive, HER2-negative breast cancer. N Engl J Med 2020;383:2557-70. 2. Schmid P, Cortes J, Dent R, et al. Event-free survival with pembrolizumab in early triple-negative breast cancer. N Engl J Med 2022;386:556-67. 3. Modi S, Jacot W, Yamashita T, et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N Engl J Med 2022;387:9-20. 4. Kalinsky K, Barlow WE, Gralow JR, et al. 21-gene assay to inform chemotherapy benefit in node-positive breast cancer. N Engl J Med 2021;385:2336-47. 5. Agostinetto E, Gligorov J, Piccart M. Systemic therapy for early-stage breast cancer: learning from the past to build the future. Nat Rev Clin Oncol 2022;19:763-74. 6. Choong GM, Cullen GD, O'Sullivan CC. Evolving standards of care and new challenges in the management of HER2-positive breast cancer. CA Cancer J Clin 2020;70:355-74. 7. Marron TU, Galsky MD, Taouli B, et al. Neoadjuvant clinical trials provide a window of opportunity for cancer drug discovery. Nat Med 2022;28:626-9. 8. Pondé NF, Zardavas D, Piccart M. Progress in adjuvant systemic therapy for breast cancer. Nat Rev Clin Oncol 2019;16:27-44.