*僅供醫學專業人士閱讀參考
這份報告最好別是真的,能讓FDA跟著著急……
Harmony Biosciences這些年過得很滋潤。公司不大,卻研發出一款罕見病孤兒藥WAKIX( pitolisant),該藥物被用於治療發作性睡病(EDS),2019年通過FDA批准在美上市後一路順風順水。
一招鮮,吃遍天。Harmony的利潤2年增長了近6倍。藥物銷售額從去年的3.054億美元增長43%,至4.379億美元。而且WAKIX這款藥還正準備在中國上市,已經在海南樂城先行區開了首張處方。
Harmony正準備帶著WAKIX進軍中國,Scorpion Capital出示了一份長達366頁的報告,把WAKIX貶低得一無是處。
Scorpion不但聲稱WAKIX的療效有限,還在臨床試驗弄虛作假,並在獲批上市後,誘導醫生開出適應症外的處方,還事實上導致了13名患者在用藥後死亡,並且隱瞞了相關情況。
駭人聽聞啊!
嗜睡是一種常見疾病,但是並不是所有患者會因為嗜睡真正睡著。EDS患者表現為病理性睡眠(也稱白天過度嗜睡症)或伴有猝倒、睡眠幻覺以及睡眠癱瘓的一組臨床綜合徵,以多種睡眠障礙為主要特點,最核心的症狀為白天突發的不可抗拒的睡眠發作。是一種罕見疾病。
美國睡眠醫學會(AASM)發布的睡眠障礙國際分類第3版將發作性睡病分為2型,包括發作性睡病1型(發作性睡病伴有猝倒),發作性睡病2型(發作性睡病不伴猝倒)。
WAKIX選擇了一種被認為沒有成癮可能性的路線,它可以提升大腦中的神經遞質水平,以此提升患者清醒度。

這款藥一經推出就取得了不小的成功,並扶持Harmony成功上市,有消息稱,Scorpion在2021年就盯上了Harmony。
臨床試驗就做錯了?
Scorpion的質疑從臨床試驗的主要終點開始。Scopion直接玩了一票大的,直接批評EDS的主要終點有問題。
和許多「稀奇古怪」的CNS疾病一樣,判斷EDS臨床改善主要通過主觀的患者調查報告來完成,而評價嗜睡的量表Epworth Sleepness Sleepiness Scale(ESS)是1990年由一名私人醫生編寫的,有太多的偏見和不準確,會讓患者困惑,並有可能獲得指導性答案。有許多相關文獻都質疑了ESS的有效性。

連FDA很清楚這個量表可能不太可靠,所以也抱有著謹慎態度,只是出於加速審批和以往的試驗經驗對WAKIX的臨床試驗表現出了一定程度的寬容。
Scorpion還認為WAKIX的試驗設計把主要終點的持續時間一縮再縮,從8周的分數變化一路縮短到4周的分數變化,是藥物不起作用的表現,正是因為藥物不起作用,才需要通過縮短試驗時間掩蓋藥物的不可靠。
但最恐怖的指控莫過於Scorpion認為WAKIX造成了13例受試者死亡,這一信息是Scorpion基於《信息公開法》,向FDA申請得到的。
在海外臨床試驗中,WAKIX組總共出現過13例死亡案例,而安慰劑組這一數字為0。FDA在臨床試驗進行時似乎就已經意識到了這些問題,並對死亡受試者進行調查,死亡報告中頻繁出現呼吸衰竭與心臟衰竭情況。
但FDA最終得出的結論是,該藥物與死亡事件的聯繫並不明確,有風險,但不一定直接相關。一個理由是2019年之前該藥物相關試驗並沒有那麼多的嚴重不良反應事件發生。

最終,WAKIX得以上市,但上市後,依然有源源不斷的嚴重不良反應事件報告。
所以這款治療嗜睡症的藥物,為什麼有可能造成患者心肺衰竭死亡?
難道從臨床前研究就做錯了?
WAKIX是一款組胺受體(H3R)拮抗劑。抗組胺藥物是一個龐大的類群,一般大眾吃這種藥,多半用於抗過敏治療,因為組胺是過敏反應發生的罪魁禍首之一。組胺仿佛是人類公敵,罪大惡極,但事實上,組胺是人體中極其常見的活性物質,功能多樣。
與組胺相關的受體有四種,H1R引起過敏反應、H2R調節胃酸分泌、H4R參與人體免疫反應,H3R則與睡眠、學習、記憶等大腦活動密切相關。這是因為H3R既能充當自身受體控制組胺的合成和周轉,也可以抑制包括多巴胺在內的其它神經遞質的分泌與釋放。總之,人類已經認識到了H3R拮抗劑在神經科學(CNS)領域的潛力。
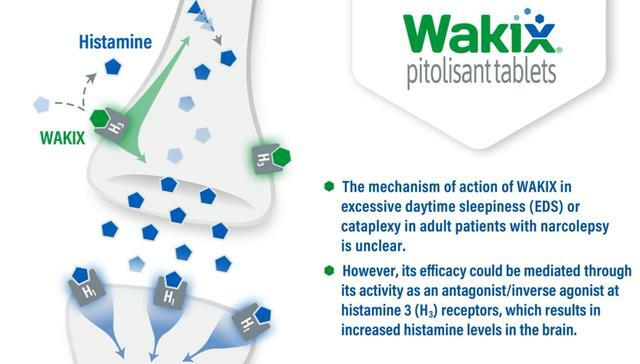
但問題是,儘管H3R主要存在於中樞神經系統(腦)中,但也在外周神經系統中有一定程度的表達,偏偏這樣的低表達有可能是致命的——H3R拮抗劑似乎會阻止心臟的收縮和舒張,其原理尚不明確,一種可能性是H3R拮抗劑干擾了心房心室的電信號。
組胺受體拮抗劑導致心率失常並非個例,早在1997年,FDA就召回過已經上市13年的Terfenadine(特菲那定),正是由於這款藥引發了患者的心律不齊。該藥物在1996年銷售額超過四億美元,該事件也一度成為FDA最大規模召回事件之一,至今影響深遠。
Scorpion說,WAKIX比Terfenadine,有過之而無不及。
上市之後「坑蒙拐騙」?
Scorpion聲稱,WAKIX獲批上市後,引誘醫生開出適應症外的處方。
原因也好理解,能得這麼嚴重嗜睡症的患者並不多見,大約只占嗜睡症患者的12%。所以為了擴大患者人群,WAKIX被推薦給了有嗜睡情況,但不符合白天過度嗜睡(EDS)或者猝倒兩項適應症的患者。

加上嗜睡評價量表本來就比較模糊,醫生的裁量權很大,為非適應症患者開出WAKIX處方的可能性確實是有的。
Scorpion對多名處方醫生與銷售代表進行了訪談,還總結出兩點其它原因:
1.醫生對這種藥物失望,WAKIX似乎並沒有達到預期療效。「醫生與患者的興奮已經褪去。」
2.銷售代表的銷售額壓力巨大。「適應症患者數量在減少,藥品銷售額卻在增加。」
豈不是從頭錯到尾?
Scorpion的報告進行了為期四個月的調查才得出結論,並對包括對50名前雇員和高管,14名醫生的16次研究訪談,5名試驗調查員和4名高級科學家的相關人士做了採訪,整部報告三百餘頁,拉了不少文獻和臨床數據出來說話。
若說完全是憑空捏造,那也是煞費苦心了。
按照Scorpion的說法,這款藥臨床前研究、臨床試驗、上市銷售都出了問題。如果這都是真的,那確實是讓FDA和歐洲藥監局顏面掃地。
而WAKIX並沒有正面駁斥Scorpion的這份報告,相反,反而在報告發布後宣布,將加快完成其3期INTUNE研究的時間表,評估WAKIX在成人特發性嗜睡症(IH)患者中的安全性和有效性。IH是一種少見的慢性神經系統疾病,其特徵是在充足甚至長時間睡眠的情況下,仍以過度的日間嗜睡(EDS)為特徵。此前WAKIX並沒有IH的適應症。
這一回應進一步「激怒」了Scorpion,Scorpion宣布要在本周一之前向FDA遞交公民請願書,要求撤回WAKIX的上市批准。昨天晚上(美東時間的4月3日),Scorpion按時按點發了請願書,還是一路鬧到了FDA那裡。
解鈴還須繫鈴人,看看FDA會對此事作何回應。

如果幾個月後我們發現FDA撤回了WAKIX的上市批准,那我們應該知道這份報告,怕是打在Harmony上,痛在FDA上……
想了解發作性睡病治療方案?
《「說睡就睡」的睡眠障礙,一張表告訴你如何治療!》
掃描二維碼或點擊閱讀原文即可獲取全文
參考文獻:
1.Terfenadine ((±)-Terfenadine,特非那定) - 僅供科研 | Caspase激動劑 | MCE (medchemexpress.cn)
2.Why Harmony Biosciences shares are down more than 20% - Philadelphia Business Journal (bizjournals.com) Scorpion Capital | Activist short selling focused on publicly traded frauds and promotes
4.Harmony官網與WARKIX藥物官網
5.HERG, a primary human ventricular target of the nonsedating antihistamine terfenadine - PubMed (nih.gov)
6.其它網際網路公開資料
本文首發:藥時代
責任編輯:黃藍
* "醫學界"力求所發表內容專業、可靠,但不對內容的準確性做出承諾;請相關各方在採用或以此作為決策依據時另行核查。
投稿郵箱:[email protected]