3月1日,DNA治療藥物龍頭企業 Inovio Pharmaceuticals 公布了其自主研發的全球首個針對HPV感染相關宮頸癌前病變的治療性DNA疫苗VGX-3100的3期臨床試驗(REVEAL 2)最新數據,結果積極。該藥有望成為治療宮頸癌前病變的第一個非手術治療藥物,以及治療宮頸HPV病毒感染的第一個獲批藥物。

宮頸癌是最常見的婦科惡性腫瘤之一,據統計,2022年全球女性宮頸癌新發病例數為60.4萬,死亡病例數為34.2萬。HPV疫苗是目前預防宮頸癌的有效手段,全球已獲批多款疫苗,近年來接種率也在不斷提升,但對於已感染HPV的患者而言,疫苗無法有效控制或預防相關的疾病進展,傳統的手術通過切除癌前病變組織或者癌變組織實現治療目的同時也存在術後出血、感染、復發的風險。
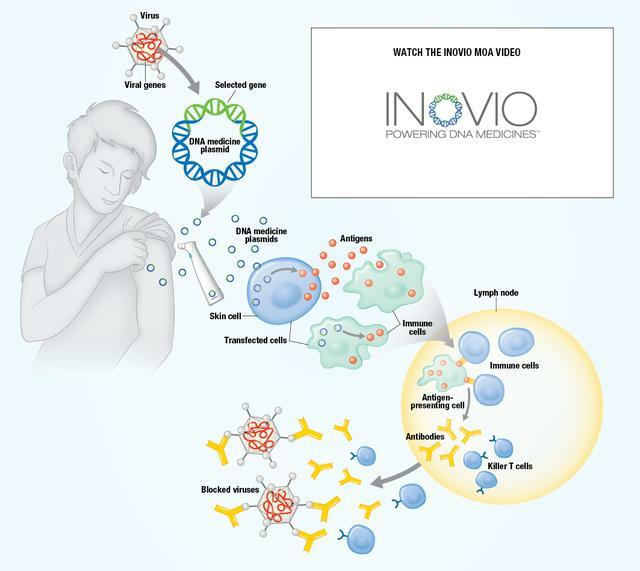
VGX-3100屬於DNA免疫療法,是目前全球唯一一款完成了III期臨床的宮頸癌前病變治療藥物。VGX-3100包含了針對HPV 16型、18型的E6、E7蛋白的DNA質粒,進入人體後通過激活抗原特異性CD8+T細胞,持續清除HPV-16、18型病毒感染,治療HPV引發的宮頸癌前病變。同時,VGX-3100採用電穿孔肌肉給藥,使用專有的智能設備CELLECTRA 5PSP將優化的DNA質粒直接輸送到肌肉或皮膚的細胞之中,這一給藥方式此前已被證明可以進一步增強DNA疫苗誘導的免疫反應。
2021年3月,Inovio Pharmaceuticals宣布關鍵性III期臨床試驗Reveal 1達到了主要和次要臨床終點,在193例療效可評估患者中,治療組有23.7%(31/131)的患者達到了實現宮頸高級別鱗狀上皮內病變(HSIL)病變組織學轉歸和HPV16/18病毒清除的共同主要終點,而安慰劑組為11.3%(7/62),這一結果具有統計學意義差異。
Reveal 2是在Reveal 1的基礎上進行的一項全球多中心、隨機、雙盲、安慰劑對照臨床試驗,重點在於評估VGX-3100治療HPV 16/18相關HSIL的有效性。研究共入組203名子宮頸鱗狀上皮內瘤變(CIN)2級和3級患者,其中治療組134名,安慰劑組69名。患者在第0、1和3個月分別接受VGX-3100或安慰劑肌肉注射伴隨電脈衝給藥,觀察至首次給藥後40周。
結果顯示,治療組 27.6% (37/134)的參與者達到主要終點(組織病理學轉歸且病毒清除),而安慰劑組為 8.7% (6/69),達到了統計學顯著性差異。尤其在病毒清除方面,治療組的病毒清除率為 37.3% (50/134),而安慰劑組為 8.7% (6/69)。安全性方面,沒有報告與治療相關的嚴重不良事件。
目前,VGX-3100已完成兩項國際多中心III期研究,預計有望儘快上市,而一旦獲批上市,該藥將是全球首個被開發用於治療 HPV 相關癌前病變(宮頸癌前病變、肛門癌前病變、外陰癌前病變等)的非手術治療手段以及全球首個DNA 藥物。
值得一提的是,在國內,2022年7月北京東方略生物醫藥科技股份有限公司(ApolloBio)與Inovio達成獨家合作協議,ApolloBio出資3500萬美元獲得了VGX-3100在中國(包括台灣、香港和澳門地區)的研發和商業化權利。

尋求廣告投放、會議合作、企業傳播等請聯繫400-689-7892。