來源 | 賽柏藍器械
特約作者 | 張自然
責編 | 秦酒
根據安全性風險由小到大,將醫療器械分為一、二、三類。其中,第一類由市級藥監部門備案,第二類、第三類分別由省級藥監局、國家藥監局審批,進口醫療器械統一由國家藥監局受理。
2022年,國家藥監局共批准醫療器械各類註冊11942項,其中,首次註冊2500項(含境內第三類1884項、進口第二類309項、進口第三類347項),延續註冊5218項,變更註冊4224項。
各省級藥監局共批准境內第二類醫療器械註冊32889項,其中,首次註冊13334項、延續註冊10641項、變更註冊8914項。
本文僅對2022年醫療器械首次註冊情況進行分析,並從品類、省、市、進口來源國及企業分布等5個方面展開。
01 品類
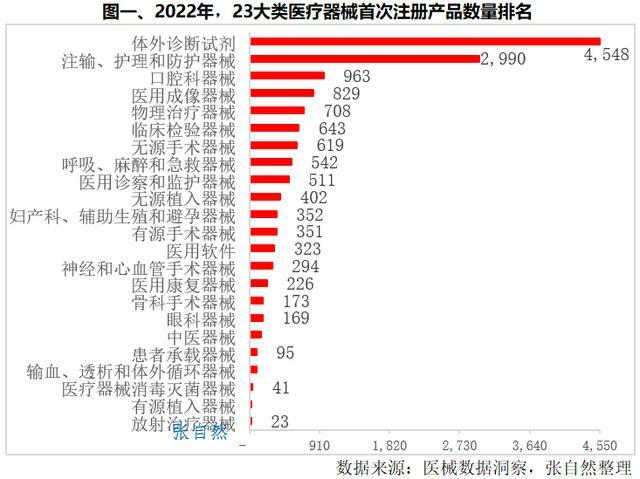
2022年,首次註冊產品最多的是體外診斷,共註冊了4548件。其次是注輸、護理和防護器械首次註冊了2990件,二者占了2022年23大類首次註冊醫療器械總數的一半。
首次註冊產品數超過600件的有5類產品,即口腔科器械(963件)、醫用成像器械(829件)、物理治療器械(708件)、臨床檢驗器械(643件)和無源手術器械(619件)。(詳見圖一)
02 省
一、第三類:江蘇最多
2022年,國家藥監局共批准境內第三類醫療器械首次註冊1844項,涉及26個省份。其中,江蘇(395件)、廣東(319件)、北京(254件)、上海(174件)和浙江(145件)等5個沿海經濟發達省份占了70%。貴州、寧夏、青海、新疆和西藏等西部5省份為空白。(詳見圖二)
二、第二類:湖南第一
2022年,各省級藥監部門共批准境內第二類醫療器械首次註冊13334項。
其中,首次註冊最多的湖南(2261件)、廣東(2086件)和江蘇(1803件)三省合計占了全國的46%。
其次是浙江(711件)、山東(653件)、河南(642件)、吉林(637件)和湖北(564件)等5省都超過了500件。首次註冊產品數量最少的是西藏(2件)、新疆及新疆生產建設兵團(9件)、寧夏(10件)、青海(18件)和內蒙古(28件)等西部5省份。(詳見圖二)
三、創新器械:北京最多
2022年,國家藥監局共批准55個創新醫療器械產品上市,同比增加57.1%。
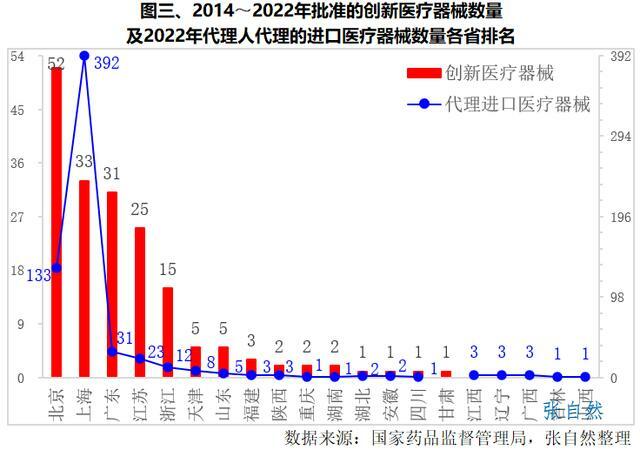
2014~2022年,國家藥監局累計批准了189個創新醫療器械上市,其中,北京(52件)、上海(33件)、廣東(31件)、江蘇(25件)和浙江(15件)等5個省份獲批產品數量最多,占了獲批總數的82.5%。(詳見圖三)
四、進口代理:上海第一
2022年,國家藥監局共批准進口醫療器械首次註冊656項(含第二類309項、第三類347項),由18個省份的代理人代理。其中,上海市代理人代理的進口首次醫療器械數量最多,代理了392個,占全部進口醫療器械數量的六成。其次是北京(133個)、廣東(31個)和江蘇(23個)。(詳見圖三)
03 市
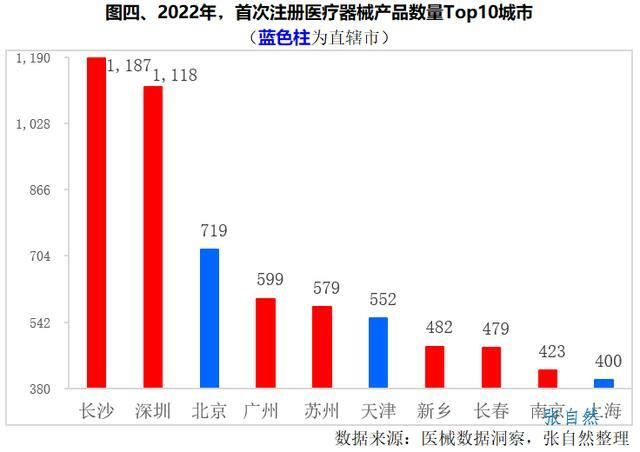
下面再對各城市醫療器械首次註冊情況進行排名,2022年,長沙市首次註冊醫療器械1187件,位居全國第一,深圳(1118件)、北京(719件)、廣州(599件)和蘇州(579件)排名第2~第5位。三大直轄市北京(719件)、天津(552件)和上海(400件)屈居第3、第6和第10位。(詳見圖四)
04 進口來源國
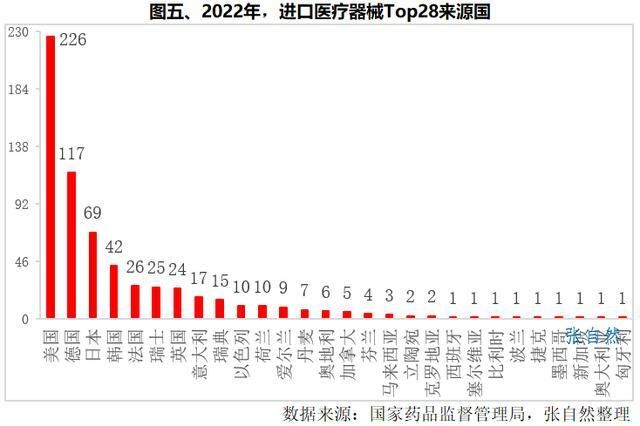
2022年,國家藥監局共批准進口醫療器械首次註冊656項(含第二類309項、第三類347項),涉及28個國家,其中,從美國進口最多,進口了226個產品,占了進口產品總和的36%。
其次是德國(117個)、日本(69個)、韓國(42個)和法國(26個),上述5國合計占了進口醫療器械首次註冊總數的七成以上。(詳見圖五)
05 企業
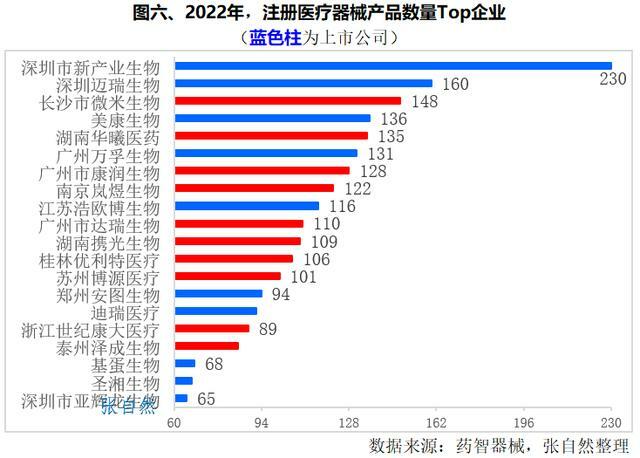
2022年,首次註冊醫療器械產品數量最多的企業是深圳市亞輝龍生物科技股份有限公司,共註冊了230件。
深圳邁瑞生物醫療電子(160件)、長沙市微米生物科技(148件)位居第2~3位。
2022年首次註冊產品數量超過120件的還有美康生物科技(136件)、湖南華曦醫藥(15件)、廣州萬孚生物技術(131件)、廣州市康潤生物科技(128件)和南京嵐煜生物科技(122件)等5家企業。(詳見圖六)
隨著研發能力的不斷提高,我國醫療器械獲批新產品不斷增多,國產替代能力不斷加強,患者對醫療器械的可及性正在不斷提高。