*僅供醫學專業人士閱讀參考
新型ADC布局廣泛,有望全面覆蓋乳腺癌獲益人群。
隨著抗體藥物偶聯物(ADC)在HER2低表達乳腺癌患者中療效的確立, 新型ADC已然成為HER2低表達晚期乳腺癌患者新的治療選擇。T-DXd作為新型ADC藥物的代表,在今年的聖安東尼奧乳腺癌大會(SABCS)上,攜多項HER2低表達乳腺癌相關研究數據重磅亮相。例如首個在HER2低表達乳腺癌中進行的III期臨床試驗DESTINY-Breast04,就公布了亞組分析數據。基於上述背景,醫學界腫瘤頻道誠邀北京大學人民醫院王殊教授深入解讀相關研究進展,並闡述其對HER2低表達乳腺癌臨床實踐的影響。
2022年SABCS大會中有什麼HER2低表達領域相關的研究進展?請您分享一下研究進展?
王殊教授:DESTINY-Breast04研究是首個在HER2低表達乳腺癌治療領域取得突破性療效的III期臨床試驗,研究結果奠定了T-DXd作為針對HER2低表達乳腺癌標準治療選擇的地位。2022 SABCS DB04研究攜亞組分析成果驚艷亮相。
T-DXd作為新型ADC藥物的「佼佼者」,已經在HER2陽性晚期乳腺癌治療領域獲得了令人驚艷的成果,重新樹立了晚期二線治療新標準。並且也開啟了HER2低表達乳腺癌的抗HER2治療新時代。DB04研究是一項全球多中心非盲隨機對照III期臨床試驗,共入組557例既往接受過1-2線化療的HER2低表達不可切除和(或)轉移性乳腺癌患者,按2∶1的比例隨機分入T-DXd組或醫師選擇化療組(TPC:卡培他濱、艾立布林、吉西他濱、紫杉醇或白蛋白紫杉醇)。

圖1. DB04研究設計
2022年ASCO大會首次公布DB04研究成果,並同步發表於《新英格蘭醫學雜誌》(NEJM)。結果顯示[1]:
主要終點方面,經盲態獨立中心審查(BICR)評估,HR陽性患者中T-DXd組的中位PFS為10.1個月,是化療組5.4個月的近2倍,疾病進展或死亡風險降低49%(HR=0.51;95% CI:0.40-0.64;p<0.001)。
關鍵次要終點方面:
-
在總體人群中,T-DXd組BICR評估的中位PFS為9.9個月,顯著優於化療組的5.1個月,疾病進展或死亡風險降低50%(R=0.50;95% CI:0.40-0.63;p<0.001)。
-
HR陽性患者中,與化療組17.5個月相比,T-DXd組的中位OS為23.9個月,死亡風險降低36%(HR=0.64;95% CI:0.48-0.86;p=0.003)。
-
在總體人群中,T-DXd組的中位OS同樣更優,兩組分別為23.4個月和16.8個月(HR=0.64;95% CI:0.49-0.84;p=0.001)。
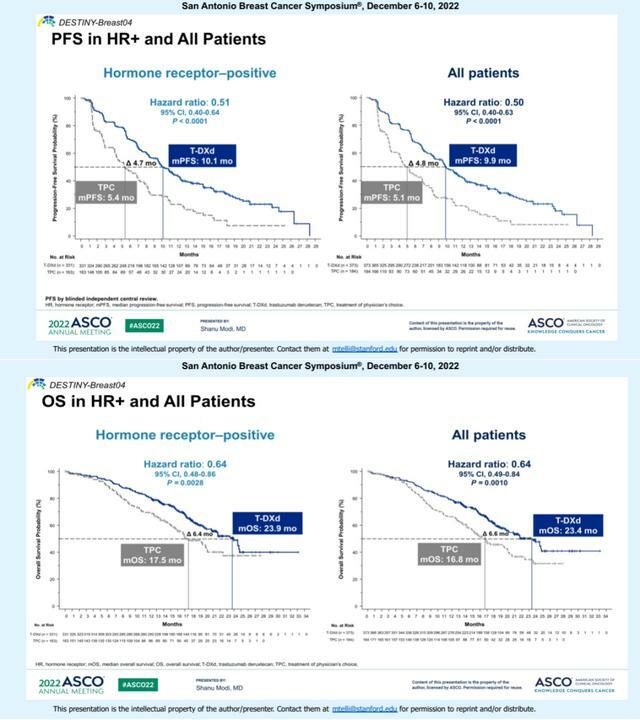
圖2. HR陽性和總人群的PFS和OS
結果還顯示,在HR陽性隊列中,T-DXd組的ORR為52.6%,是化療組16.3%的三倍之多,並且T-DXd組有12例(3.6%)患者達到完全緩解(CR),疾病控制率(DCR)為88%,中位緩解持續時間(DOR)為10.7個月。在總體人群中,ORR為52.3%,DCR為87.1%,中位DOR為10.7個月,與HR陽隊列結果類似。
2022年SABCS大會公布了DB04研究的亞組分析數據[2],包括是否CDK4/6抑制劑經治、不同疾病負荷狀態(低:0-2處轉移灶;高:3個及以上轉移灶)、疾病是否快速進展(疾病快速進展定義:早期乳腺癌患者結束之前一個療程化療後6個月內的疾病進展)、基線是否腦轉移等亞組均顯示出與總體人群一致的獲益趨勢。其中CDK4/6抑制劑經治亞組(HR陽性人群)的中位PFS,T-DXd和TPC組分別為10.0個月和5.4個月,兩組的ORR分別為50.6%和13.0%;高疾病負荷亞組的中位PFS兩組為9.5個月和4.8個月,ORR分別為51.1%和17.2%。總體而言,T-DXd組均顯示出明顯獲益優勢。
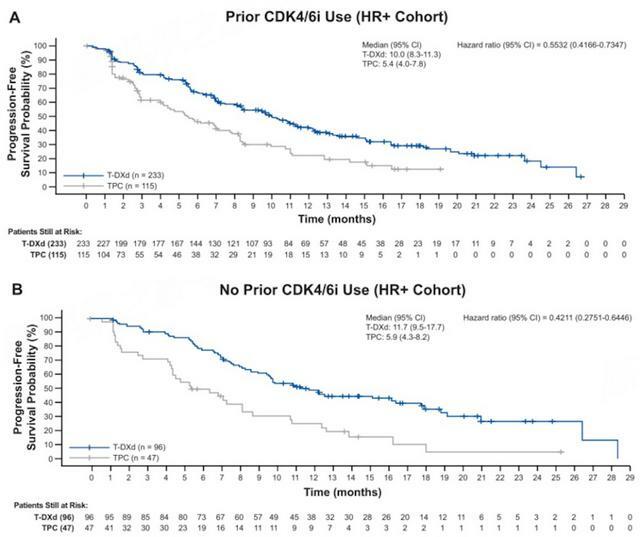
圖3. 是否CDK4/6抑制劑經治HR陽性患者的PFS
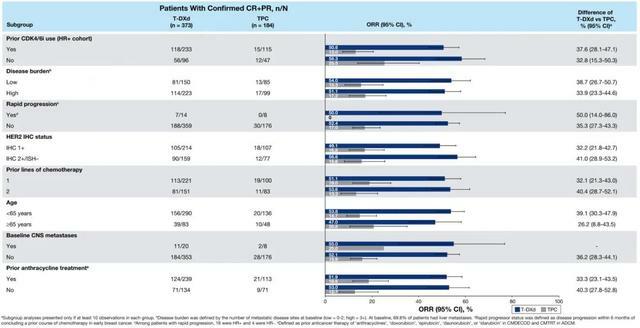
圖4.不同亞組的ORR
DB04研究表明,T-DXd是第一個與TPC相比,在PFS和OS方面表現出前所未有的具有統計學意義和臨床意義改善的抗HER2 ADC藥物。並且所有亞組的獲益趨勢相似。安全性特徵與既往報告一致,總體獲益大於風險。該研究還打破了抗HER2治療僅針對HER2陽性乳腺癌有效的局限性,確立HER2低表達(IHC 1+、IHC 2+/ISH-)轉移性乳腺癌為新的可靶向治療人群,具有很大的臨床實踐意義。而T-DXd有望成為首個針對HER2低表達乳腺癌的標準治療藥物,期待未來能惠及更多患者。
既往以曲妥珠單抗為代表的傳統抗HER2治療藥物顯著改善了HER2陽性乳腺癌的生存獲益,但是在HER2低表達乳腺癌中的探索卻以失敗告終,而新型ADC藥物的相關研究探索猶如一道曙光,為HER2低表達乳腺癌患者帶來了新的希望,請結合相關進展談談您如何看待新型ADC藥物在HER2低表達乳腺癌中的治療價值?
王殊教授:ADC藥物兼具單克隆抗體的特異性靶向和細胞毒藥物的強效殺傷作用,尤其T-DXd作為新型ADC藥物,其結構設計和作用機制都得到進一步優化,不僅能精準靶向腫瘤細胞,而且得益於可裂解連接子和載藥的膜滲透性,以及藥物抗體比(DAR)達到理論高值8等獨特屬性,T-DXd還能發揮強效旁觀者效應,針對HER2低表達乳腺癌同樣有效[3-5],其卓越實力也在DB04研究中得到了充分證實。
而回顧既往抗HER2治療藥物在HER2低表達乳腺癌中的研究探索均不盡人意:
-
NSABP B47研究[6]中,曲妥珠單抗輔助治療未能給IHC 1+或IHC 2+/FISH-的患者帶來獲益,化療聯合曲妥珠單抗相比單用化療的IDFS獲益類似(5年IDFS率: 89.8% vs 89.2%,HR=0.98,95% CI,0.76-1.25,P=0.85)。
-
帕妥珠單抗的一項II期研究[7]納入78例IHC 0、1+或IHC 2+/FISH-晚期後線乳腺癌患者,總體客觀緩解率(ORR)僅2.5%。
-
拉帕替尼兩項III期臨床研究EGF100151和EGF30001的聯合分析顯示[8],IHC >0、FISH-患者並不能從拉帕替尼的治療中獲益(拉帕替尼聯合化療相比單獨化療組的PFS,p=0.8823,HR=0.97)。
-
T-DM1的兩項II期單臂研究(4258g和4374g),納入標準為研究者診斷為HER2陽性,經中心實驗室檢測發現分別有21例和15例為HER2陰性。在單臂、Ⅱ期研究TDM4258g中[9],T-DM1 對HER2低表達患者的客觀緩解率(ORR,4.8% vs 33.8%)和中位無進展生存期(PFS,2.6個月 vs 8.2個月)顯著低於HER2陽性患者。同樣在T-DM1的Ⅱ期研究TDM4374g中[10],探索性亞組分析也得到了相似的結果,兩類人群的ORR(20.0% vs 41.3%)和中位PFS(2.8個月 vs 7.3個月)相差懸殊。
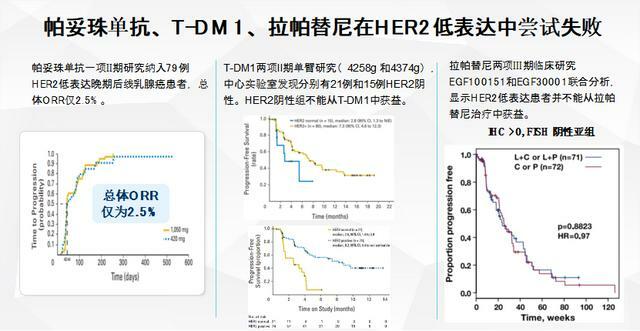
圖5. 帕妥珠單抗、T-DM1、拉帕替尼在HER2低表達乳腺癌中的嘗試均以失敗告終
以T-DXd為里程碑,打破了HER2低表達乳腺癌抗HER2治療無效的困境,開拓了新局面。早在I期DS8201-A-J101研究[11]中,就曾納入54例HER2低表達(IHC1+,IHC2+/ISH-)患者接受T-DXd治療,患者歷經中位7.5線的既往治療後,獨立審查委員會評估的ORR高達37%,疾病控制率(DCR)高達87%,中位緩解持續時間(DOR)和中位PFS分別長達為10.4個月和11.1個月,所有亞組都觀察到了獲益。同時2021年SABCS公布的DAISY研究數據表明[12],T-DXd在整體人群的最佳緩解率(BOR)為48.6%,中位DOR為8.5個月,中位PFS為7個月。在HER2高表達、低表達和HER2 0隊列中,BOR分別為70.6%、37.5%和29.7%,中位PFS分別為11.1個月、6.7個月、4.2個月。研究結果進一步驗證了T-DXd對HER2低表達乳腺癌的治療有效性。而DB04研究打破了既往按照曲妥珠單抗治療有效定義HER2陽性乳腺癌的傳統局面,自此乳腺癌HER2三分法時代全面開啟。
後續越來越多新型ADC藥物也在HER2低表達領域展開了積極探索:
-
在RC48的I期劑量遞增C001 CANCER(NCT02881138)和Ib期C003 CANCER(NCT03052634)兩項研究的匯總分析[13]中,共納入48例HER2低表達乳腺癌患者。結果表明,ORR和中位PFS分別為39.6%和5.7個月。其中IHC 2+/ISH-患者的ORR和中位PFS分別為42.9%和6.6個月。對於IHC 1+ 患者,由於COVID-19大流行導致一些患者治療延遲,其ORR和中位PFS分別為30.8%和5.5個月。目前RC48針對HER2低表達轉移性乳腺癌的Ⅲ期研究正在開展中,尚未有相關數據披露。
-
SYD985的Ⅰ期劑量爬坡研究[14]中,共納入47例HER2低表達乳腺癌患者,其中針對32例HR陽性HER2低表達乳腺癌患者,其ORR為28%,中位PFS為4.1個月;針對15例 HR陰性HER2低表達乳腺癌患者,其ORR為40%,中位PFS為4.9個月。SYD985治療HER2低表達乳腺癌尚需要更多臨床研究證據的積累。
-
在MRG002治療HER2低表達晚期或轉移性乳腺癌的多中心II期臨床研究[15]中,共納入56例HER2低表達乳腺癌患者,截至2022年4月20日,52例可評估患者的ORR和DCR分別為33%和75%,中位PFS為5.6個月。儘管MRG002的II期臨床研究顯示出初步療效,但是仍需進一步的III期臨床探索加以確證。
總體而言,當前在HER2低表達乳腺癌治療領域,T-DXd已表現出不可比擬的卓越實力。未來T-DXd作為乳腺癌新時代的「主角」,將始終引領HER2低表達治療探索新賽道的發展。
過去HER2低表達往往被納入TNBC或者HR+/HER2-乳腺癌的範疇,而隨著新型ADC藥物的湧現,HER2低表達乳腺癌又重新受到重視。在HER2陽性乳腺癌治療領域,新型ADC藥物帶來的生存獲益更是不可比擬,據此請談談您認為新型ADC藥物在乳腺癌治療排兵布陣中發揮著哪些重要作用?
王殊教授:T-DXd基於一系列驚艷的療效數據,為乳腺癌治療領域帶來了諸多理念上的更新和思考,也為臨床提供了極具應用前景的新型治療選擇。
在HER2陽性乳腺癌治療領域,基於DB03研究的突破性成果,T-DXd已經奠定晚期二線標準治療地位;未來基於DB09研究或將衝擊晚期一線。不僅如此,DB11研究和DB05研究還分別探索了T-DXd在早期乳腺癌新輔助以及輔助治療領域的應用價值,期待研究結果早日公布,能進一步豐富早期乳腺癌臨床治療策略。
HER2低表達已然成為近年來乳腺癌診療領域的關注熱點,傳統的HR+/HER2-乳腺癌以及三陰性乳腺癌(TNBC)中均覆蓋了一定比例的HER2低表達乳腺癌患者,過去乳腺癌的治療策略依據分子分型而定,而隨著新型ADC藥物T-DXd在HER2低表達乳腺癌患者中療效的確立,以治療為導向的新型乳腺癌治療格局正逐步形成。
-
在內分泌難治的HR+/HER2-晚期乳腺癌治療領域,基於DB04研究,未來T-DXd可能會成為二線及以後的主流治療選擇(HER2低表達)。
-
在TNBC治療領域,基於DB04研究,T-DXd或將成為二線及以後的優選方案(HER2低表達)。
總之,T-DXd將全面覆蓋乳腺癌獲益人群,並不斷嘗試新的探索方向,以期讓患者獲益最大化。
專家簡介
王殊 教授
-
醫學博士,主任醫師。現任北京大學人民醫院乳腺中心主任,博士生導師。
-
中國臨床腫瘤學會乳腺癌專業委員會(CSCO-BC)常委,中國抗癌協會乳腺癌專業委員會(CBCSG)常委,中華醫學會外科學分會乳腺學組委員。
參考文獻:
[1]Modi S, Jacot W, Yamashita T, et al. DESTINY-Breast04 Trial Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20.
[2]Harbeck N, Modi S, Jacot W, et al.Trastuzumab Deruxtecan vs Treatment of Physician's Choice in Patients With HER2-Low Unresectable and/or Metastatic Breast Cancer: Subgroup Analvses From DESTINY-Breast04. 2022 SABCS. P1-11-01.
[3]Ogitani Y, Aida T, Hagihara K, et al. DS-8201a, A Novel HER2-Targeting ADC with a Novel DNA Topoisomerase I Inhibitor, Demonstrates a Promising Antitumor Efficacy with Differentiation from T-DM1. Clin Cancer Res. 2016 Oct 15;22(20):5097-5108.
[4]Nakada T, Masuda T, Naito H, et al. Novel antibody drug conjugates containing exatecan derivative-based cytotoxic payloads. Bioorg Med Chem Lett. 2016 Mar 15;26(6):1542-1545.
[5]Nakada T, Sugihara K, Jikoh T, et al. The Latest Research and Development into the Antibody-Drug Conjugate, [fam-] Trastuzumab Deruxtecan (DS-8201a), for HER2 Cancer Therapy. Chem Pharm Bull (Tokyo). 2019;67(3):173-185.
[6]Fehrenbacher L, Cecchini RS, Geyer CE Jr, et al. NSABP B-47/NRG Oncology Phase III Randomized Trial Comparing Adjuvant Chemotherapy With or Without Trastuzumab in High-Risk Invasive Breast Cancer Negative for HER2 by FISH and With IHC 1+ or 2. J Clin Oncol. 2020 Feb 10;38(5):444-453.
[7]Gianni L, Lladó A, Bianchi G, et al. Open-label, phase II, multicenter, randomized study of the efficacy and safety of two dose levels of Pertuzumab, a human epidermal growth factor receptor 2 dimerization inhibitor, in patients with human epidermal growth factor receptor 2-negative metastatic breast cancer. J Clin Oncol. 2010 Mar 1;28(7):1131-7.
[8]Press MF, Finn RS, Cameron D, et al. HER-2 gene amplification, HER-2 and epidermal growth factor receptor mRNA and protein expression, and lapatinib efficacy in women with metastatic breast cancer. Clin Cancer Res. 2008;14(23):7861-7870.
[9]Burris HA 3rd, Rugo HS, Vukelja SJ, et al. Phase II study of the antibody drug conjugate trastuzumab-DM1 for the treatment of human epidermal growth factor receptor 2 (HER2)-positive breast cancer after prior HER2-directed therapy. J Clin Oncol. 2011 Feb 1;29(4):398-405.
[10]Krop IE, LoRusso P, Miller KD, et al. A phase II study of trastuzumab emtansine in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer who were previously treated with trastuzumab, lapatinib, an anthracycline, a taxane, and capecitabine. J Clin Oncol. 2012 Sep 10;30(26):3234-41.
[11]Modi S, Park H, Murthy RK, et al. Antitumor Activity and Safety of Trastuzumab Deruxtecan in Patients With HER2-Low-Expressing Advanced Breast Cancer: Results From a Phase Ib Study. J Clin Oncol. 2020 Jun 10;38(17):1887-1896.
[12]Diéras V, Deluche E, Lusque A, et al.Trastuzumab deruxtecan (T-DXd) for advanced breast cancer patients (ABC), regardless HER2 status: A phase II study with biomarkers analysis (DAISY).2021 SABCS. PD8-02.
[13]Wang JY, Liu YJ, Zhang QY, et al. RC48-ADC, a HER2-targeting antibody-drug conjugate, in patients with HER2-positive and HER2-low expressing advanced or metastatic breast cancer: A pooled analysis of two studies. | Journal of Clinical Oncology (ascopubs.org).
[14]Banerji U, van Herpen CML, Saura C, et al. Trastuzumab duocarmazine in locally advanced and metastatic solid tumours and HER2-expressing breast cancer: a phase 1 dose-escalation and dose-expansion study. Lancet Oncol. 2019 Aug;20(8):1124-1135.
[15]Jiang ZF, Sun T, Wang XJ,et al. A multiple center, open-label, single-arm, phase II clinical trial of MRG002, an HER2-targeted antibody-drug conjugate, in patients with HER2-low expressing advanced or metastatic breast cancer.2022 ASCO. 1102.
*此文僅用於向醫學人士提供科學信息,不代表本平台觀點