人類皰疹病毒(HHV)普遍存在,而且可在人體內終身潛伏期,當免疫力下降或其他刺激的情況下可發生HHV再激活。新冠病毒感染常伴有過度炎症反應甚至細胞因子風暴,可能增加HHV再激活的風險,但目前尚缺乏相關數據的報導。近期,一項發表於《國際感染病雜誌》(Int J Infect Dis)的系統回顧和薈萃分析探討了這一問題。

皰疹病毒是普遍存在的雙鏈DNA包膜病毒,可在初次感染宿主後建立終身潛伏。目前主要有九種HHV:
- 1型單純皰疹病毒(HSV1,口唇皰疹)
- 2型單純皰疹病毒(HSV2,生殖器皰疹)
- 水痘帶狀皰疹病毒(VZV,俗稱「纏腰龍」)
- 巨細胞病毒(CMV,常見於免疫功能低下患者機會性感染)
- 人類皰疹病毒6A(HHV6A,嗜淋巴細胞病毒)
- 人類帶狀皰疹病毒6B(HHV6B,玫瑰疹病毒)
- 愛潑斯坦-巴爾病毒(EBV,與鼻咽癌、淋巴瘤相關)
- 人皰疹病毒7(HHV7,嗜CD4+ T淋巴細胞)
- 卡波西肉瘤皰疹病毒(KSHV,常見於HIV感染者)
- 人類皰疹病毒8(HHV8,常見於卡波西肉瘤中)
HHV的感染多數具有自限性。然而,HHV通常表現出廣泛的嗜細胞性,在初次感染和再激活過程中,HHV具有裂解性病原體特徵,可侵入並破壞細胞,而且潛伏感染的細胞能夠逃脫免疫監視,在多種刺激(如免疫抑制、共感染、心理壓力等)下從潛伏期轉為裂解期。那麼,人體感染新冠病毒(SARS-CoV-2)後是否會激活體內已存在的HHV?臨床上需要關注HHV再激活帶來的潛在危害,尤其像EBV、KSHV等具有致癌能力的病毒。
目前,在COVID-19的監測中,尚缺乏有關活動性HHV感染的患病率、發生率和臨床相關性數據,仍處於研究的早期階段。儘管有一些關於新冠患者合併感染的數據,但相關的診斷和治療方案仍然不足[2-3]。為了填補這一空白,Ana Banko等人開展了一項系統性回顧和薈萃分析,以評估所有與新冠患者活動性HHV感染相關的已發表文獻。
共有36項研究、49篇病例報告納入分析,涉及超過104萬名參與者,其中9427名新冠患者,超過103萬名非新冠患者。
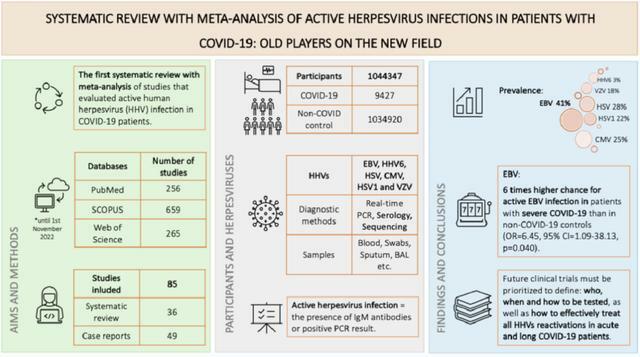
在新冠感染人群中,活動性HHV感染的患病率分別為:
- EBV:41%(95%CI:27%~57%),
- HHV6:3%(17%~54%),
- HSV:28%(1%~85%),
- CMV:25%(1%~63%),
- HSV1:22%(10%~35%),
- VZV:18%(4%~34%)。

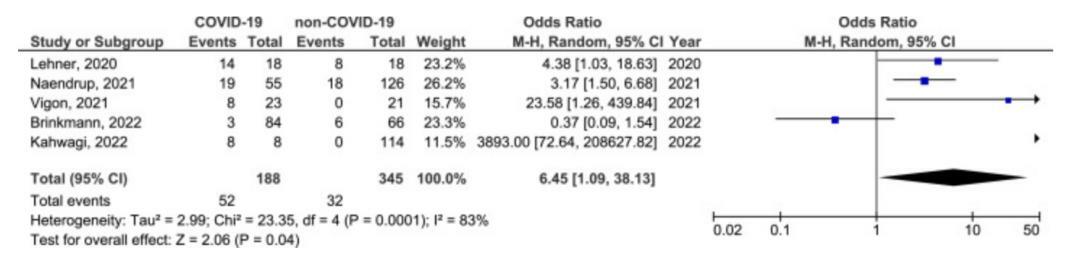
有7項研究比較了新冠和非新冠人群中HHV活動性感染的差異。
對這7項研究的薈萃分析顯示,新冠和非新冠之間的活動性EBV、CMV和HSV感染的患病率沒有顯著差異,但相較於非新冠人群,重症新冠人群的活動性EBV感染的患病率有顯著增加(OR 6.45,95%CI:1.09~38.13,P=0.040)。
總結點評
COVID-19可以引發免疫失衡,導致人體中處於潛伏期的人類皰疹病毒激活。這項系統回顧和薈萃分析結果顯示,有高達41%的新冠感染者存在EBV活動性感染,HSV、CMV、VZV等活動性感染患病率也在20%左右;而且相較於非新冠患者,重症新冠患者活動性EBV感染風險比為6倍,需注意EBV長期感染與鼻咽癌、淋巴瘤密切相關的危害。
新冠病毒入侵人體後,可通過病毒複製、干擾素活性失調和/或信號通路啟動所導致的過度炎症乃至細胞因子風暴,從而引發免疫失衡、激活HHV。其中,干擾素(IFN)是抑制HHV、使其處於潛伏期的重要因素[4-5];此外,新冠病毒使得CD4+T、CD8+T和自然殺傷(NK)細胞的耗竭,也是HHV再激活的重要原因[6]。未來需要進一步的研究,以了解HHV再激活在新冠發病過程中的確切作用及其對臨床結局的影響,並建立可行的診療方案。
參考文獻
[1]Banko A, Miljanovic D, Cirkovic A. Systematic review with meta-analysis of active herpesvirus infections in patients with COVID-19: Old players on the new field [published online ahead of print, 2023 Jan 31]. Int J Infect Dis. 2023;S1201-9712(23)00037-1. doi:10.1016/j.ijid.2023.01.036
[2] Malekifar P, Pakzad R, Shahbahrami R, Zandi M, Jafarpour A, Rezayat SA, etal. Viral Coinfection among COVID-19 Patient Groups: An Update Systematic Review and Meta-Analysis. Biomed Res. Int. 2021;5313832.
[3] Pakzad R, Malekifar P, Shateri Z, Zandi M, Akhavan Rezayat S, Soleymani M, etal. Worldwide prevalence of microbial agents』 coinfection among COVID-19 patients: A comprehensive updated systematic review and meta-analysis. J. Clin. Lab. Anal. 2022;36(1).
[4] Le-Trilling VTK, Trilling M. Attack, parry and riposte: Molecular fencing between the innate immune system and human herpesviruses. Tissue Antigens. 2015;86(1):1–13.
[5] Acharya D, Liu GQ, Gack MU. Dysregulation of type I interferon responses in COVID-19. Nat. Rev. Immunol. 2020;20(7):397–398.
[6] Zheng M, Gao Y, Wang G, Song G, Liu S, Sun D, etal. Functional exhaustion of antiviral lymphocytes in COVID-19 patients. Cell. Mol. Immunol. 2020;17(5):533–535.