肥胖機制
在過去的幾十年中,導致正能量平衡和體重增加的因素包括:人均食物供給和食用增多,尤其總是大份提供高熱量可口食物;人們在工作中所需的體力活動時間減少,工作之餘的體力活動被靜坐式的活動(如看電視和使用電子設備)所取代;有增重副作用的藥物使用逐漸增加;以及睡眠不足。這些和許多其他因素,以及減少傳染性疾病死亡率並延長壽命的醫學創新,為慢病和肥胖共同流行埋下了隱患。
遺傳因素
並非所有暴露於當下城市和農村環境的人都會變胖,這提示個體水平上潛在的遺傳機制。一些有關雙胎、家庭和收養兒童的研究顯示,體質指數(BMI)的遺傳率頗高,其範圍從40%到70%不等。目前人們已識別出11種罕見的肥胖單基因遺傳形式,其中包括瘦素和促黑素-4受體缺乏,這些受體參與調節體內能量穩態的神經迴路。促黑素-4受體基因中的雜合突變是目前單基因型肥胖的最常見原因,在重度肥胖兒童中占2%~5%。
對於產生常見肥胖易感性的多基因機制,人們在全基因組關聯研究中已發現300多個基因位點,但在BMI和脂肪性狀上,這些位點疊加只占個體差異的5%以下。其中最顯著的信號為FTO基因變異,攜帶一個或兩個該風險等位基因者與未攜帶者相比,分別增加1.2 kg或3 kg體重。全外顯子和全基因組測序為識別新的分子靶點和改進風險預測標誌物提供了可能性。環境影響無須通過DNA核苷酸序列的修飾就會造成基因轉錄和翻譯的改變,全表觀基因組關聯研究闡釋了出生前及出生後暴露可能影響代謝結局。
能量平衡失調
基因和環境在一個調節能量平衡的複雜系統中相互作用,將生理過程和體重聯繫起來。短期和長期的能量平衡受到由中樞機制和外周信號組成的協作網絡的控制,外周信號來源於脂肪組織、胃、胰腺以及其他器官內的微生物和細胞。下丘腦以外的大腦區域通過感受信號輸入、認知過程、食物消費的享樂效應(hedonic effect)、記憶和注意力等對能量平衡進行調節。
減少食物攝入或增加體力活動會導致能量負平衡,並產生級聯式中樞和外周組織代償性適應機制以保護生命功能。中樞促進食慾的信號增加可以解釋在食慾和食物攝入方面細微且通常難以察覺的負調節增加,而負調節的增加限制了與體力活動等干預相關的預期減重程度。
病理生理學特徵
解剖學效應
過度肥胖一般隨時間緩慢發展,呈現長期正能量平衡。隨著時間推移,體重增加,過量脂質會分布至許多身體隔室中。皮下脂肪組織貯存了大部分脂質(圖1)。由於貯存甘油三酯,皮下脂肪組織的大多數脂肪細胞為白色;體積相對較小而數量可變的產熱棕色和米色脂肪細胞也存在於成人體內。肥胖常伴有脂肪組織中巨噬細胞和其他免疫細胞的增加。這些免疫細胞分泌促炎性細胞因子,導致了肥胖患者中常見的胰島素抵抗。
內臟脂肪組織與皮下脂肪組織相比是一個較小的脂質貯存隔室,但網膜和腸繫膜脂肪在機制上卻與許多肥胖相關的代謝性疾病和不良結局相關。腎臟周圍包繞著脂肪組織,肥胖患者中常見的高血壓可能是腎臟受壓而引起的血壓升高所致。肥胖常伴有咽軟組織增加,睡眠期間阻塞氣道,引起阻塞性睡眠呼吸暫停。過量脂肪也會在關節施加機械負荷,使肥胖成為骨關節炎發展的風險因素。在超重和肥胖患者中,腹腔內壓力增加可導致胃食管反流病、巴雷特食管和食管腺癌風險增高。
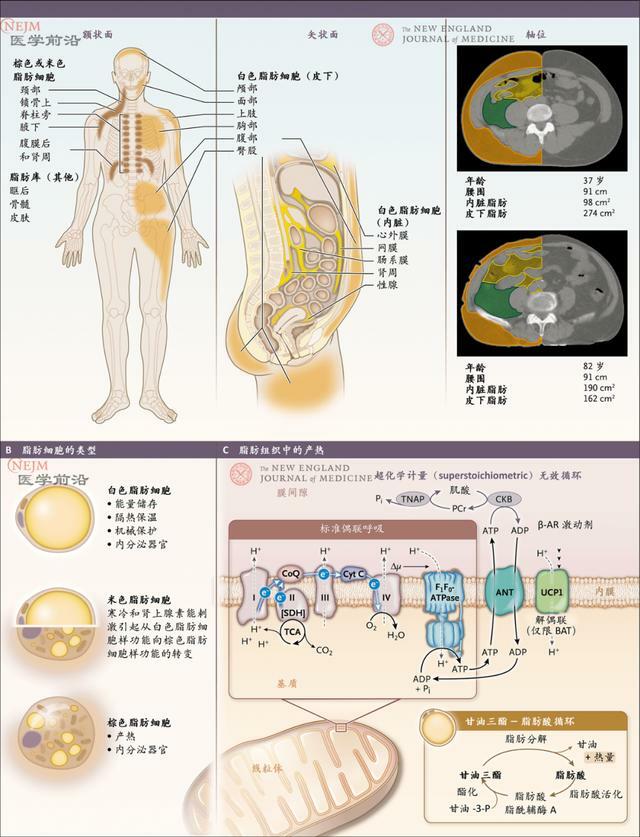
圖1. 人體脂肪組織
圖A顯示了額狀面(左)和矢狀面(中)的主要人體脂肪組織庫。棕色或米色脂肪庫繪製為棕色,橙色表示皮下白色脂肪,黃色表示內臟白色脂肪。圖A還顯示了腰圍相同但脂肪組織庫分布不同的2名男性的腹部軸位CT掃描(右)。橙色表示皮下脂肪,綠色表示腹膜後內臟脂肪,黃色表示腸繫膜內臟脂肪。圖B顯示脂肪細胞的三種主要類型及其已知生理作用。圖C顯示脂肪組織產熱的分子機制。
代謝性和生理性效應
脂肪組織內脂肪細胞和巨噬細胞過度分泌促炎脂肪因子,進而在某些肥胖者中引發低級別全身性炎症。
脂肪細胞內甘油三酯的水解會釋放游離脂肪酸,隨後會在血漿中被轉運至有代謝用途的組織或器官。肥胖患者血漿游離脂肪酸水平通常較高,這也反映出包括增大的脂肪組織團塊在內的幾處高血脂來源。
除了在脂肪組織中被發現之外,脂質也在脂質體中被發現。由於含有過量脂肪,肝細胞內脂質體尺寸增大(脂肪變性),形成伴發一系列病理狀態的大液泡,這些病理狀態包括非酒精性脂肪肝病、脂肪性肝炎和肝硬化。過多脂質中間產物(如神經醯胺)在某些非脂肪組織中的累積會造成伴發細胞功能障礙和細胞凋亡的脂毒性。
游離脂肪酸水平的升高、炎症細胞因子和非脂肪組織中的脂質中間產物引起胰島素信號受損以及胰島素抵抗狀態。胰島素抵抗和過量的腹內脂肪組織也密切相關。這一系列代謝和解剖學結果是血脂異常潛在的數種病理生理機制之一,血脂異常出現在肥胖、2型糖尿病、肥胖相關肝臟疾病和骨關節炎等疾病中。胰島素樣生長因子1和其他促腫瘤生長分子的生物利用度水平增加,也已被認為與某些腫瘤的發生有關。
一些肥胖患者存在交感神經系統慢性過度活動,部分原因可能是包括高血壓在內的多種病理生理過程。心臟疾病、卒中和慢性腎臟病的主要病理生理機制包括高血壓以及胰島素抵抗、與肥胖相關的血脂異常、與2型糖尿病相關的一系列結果(圖2)。
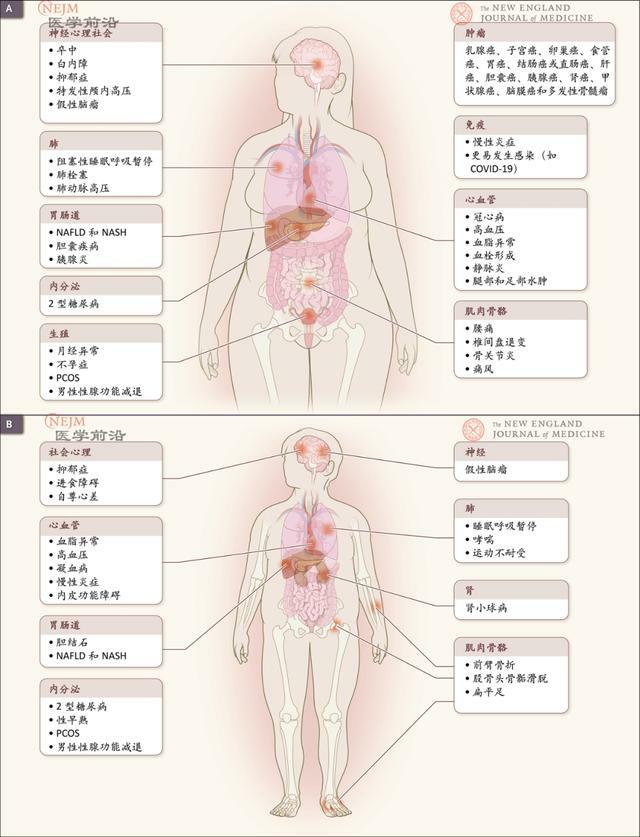
圖2. 肥胖併發症
心理學效應
肥胖與心境、焦慮和其他精神疾病的發生增加相關,在重度肥胖者和尋求減重手術者中尤其如此。肥胖和精神疾病之間的因果通路可能是雙向的。而且,用於治療雙相障礙、重度抑鬱和一些精神病症的藥物常會伴發體重大幅增加。
對減重的反應
當減少食物攝入和/或增加活動水平產生負能量平衡時,熱動力學預測模型能準確地在堅持減重的患者中定義減重軌跡。大多數患者在僅僅數月之後,能比模型預測更早達到減重低點,但此後體重逐漸增加。體重重新增加與患者對節食和運動依從性下降有關,也與內源性代償機制有關。
中度減重,定義為基線體重減輕5%~10%,在改善與肥胖相關的代謝性危險因素和伴發疾病方面具有臨床意義。減重5%可改善胰島β細胞功能以及肝臟和骨骼肌對胰島素的敏感性;更大幅度的相對減重會分級改善關鍵脂肪組織失調。
在高危人群中,中度減重能夠轉化為疾病預防效果。糖耐量受損的超重或肥胖患者在糖尿病預防項目中接受強化生活方式干預,在2.8年時平均減重5.6 kg,患2型糖尿病的危險相對降低58%;而在10年隨訪時,干預組2型糖尿病發病率仍然比對照組低34%,儘管平均而言干預組參與者已經恢復到基線體重。
重度肥胖患者通過減重手術可平均減輕16%~32%的基線體重,這能使接受手術(尤其是Y形胃旁路術)的2型糖尿病患者疾病得到緩解。在針對手術治療患者的觀察性研究中,人們也發現全因死亡率顯著降低。
儘管減重是一種有效的、作用廣泛的治療手段,但並非對所有危險因素和慢性疾病均有同樣良好的效果。例如,重度阻塞性睡眠呼吸暫停,通過包括減重手術在內的減重治療能得到改善但鮮有完全緩解。在Look AHEAD研究中,9.6年後,通過強化生活方式干預獲得的中度減重所帶來的臨床獲益並未降低心血管疾病相關發病率和死亡率。
臨床治療
評估
肥胖的表型複雜,且有些患者並無任何明顯的心臟代謝性效應,這是一種被稱為「代謝上健康的」肥胖狀態現象。與胰島素抵抗相關的一系列發現以及腹內和上身皮下脂肪組織量的增加,均與代謝綜合徵的診斷相一致。
儘管BMI能在群體水平較好地反映脂肪堆積,但每例患者的危險可根據個人和家族病史、精神疾病史、血液檢查,以及包括體力活動、營養和飲食習慣等信息在內的行為史進一步分層。腰圍也是測量腹內和上身皮下脂肪的一種有用方法,有些指南在BMI之外增加腰圍,或使用腰圍代替BMI作為危險度指標。
治療
治療應與超重嚴重程度、相關慢性共患病和功能性限制相匹配。人們可藉助指南對個體患者健康風險和治療進行評估。有充足循證支持的主要治療方法有生活方式干預、藥物治療和減重手術。
生活方式干預
對於體重管理,考慮到其低費用和最小的併發症危險,旨在改變飲食行為和體力活動的生活方式干預是首選。超重和肥胖患者的目標是通過達到並保持中度減重改善健康和生活質量(表1)。由一名訓練有素的干預治療師開展的綜合策略可平均減重5%~8%,約60%~65%的患者可減輕≥5%的初始體重。患病危險低或選擇不參加高強度項目的患者可選擇相對較低強度的生活方式輔導來預防額外的體重增加。
表1. 能達到並維持5%~10%體重減輕幅度的高強度綜合生活方式干預的推薦組分*
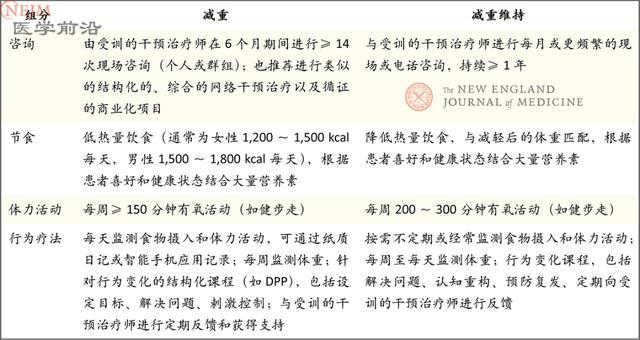
初級保健醫師常為患者提供飲食和活動調整的建議,但卻無法經常提供高強度行為諮詢。而且,儘管要在肥胖管理的一線發揮作用,但醫師在營養和活動諮詢方面接受的訓練極少。僅僅通過建議(包括鼓勵使用減重APP)產生的減重效果甚微,而且讓醫師和患者都感到灰心。因此推薦患者接受高強度社區干預是一種重要的方法。
患者在完成一個生活方式干預項目之後會普遍出現體重反彈。預防體重反彈的最有效的行為方法是,無論是通過現場諮詢還是電話方式,繼續參加每隔一周或每月的項目。儘管長期行為諮詢有效,但並不能廣泛應用。而且,當該方法不能產生患者期望的額外減重效果時,說服患者持續接受諮詢以維持其已達到的較小減重效果並不容易。
藥物治療
長期體重管理除了低熱量飲食和增加體力活動外,還可以用藥物治療作為輔助手段。對於BMI≥30或BMI 27~29且患有至少一種體重相關共患病的成人,可考慮藥物治療。藥物治療和生活方式干預會產生額外的減重效果,所以應該一起使用。藥物治療聯合生活方式干預在促進維持減重方面也可能有益(圖3)。
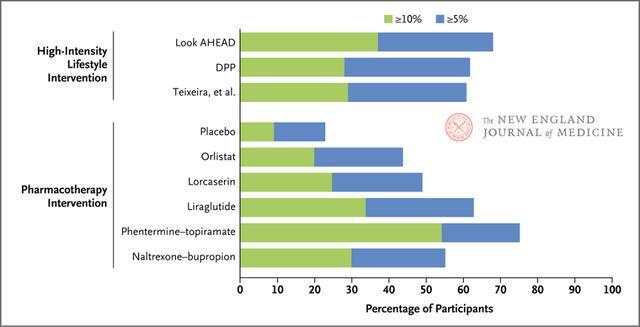
圖3.高強度生活方式干預或藥物治療結合低至中等強度生活方式輔導1年時的減重
為批准一種新減重藥物,FDA需要至少為期1年的臨床試驗以表明藥物安全性,而且要求藥物組和安慰劑組的減重效果有≥5%的差異,或者藥物組減輕≥5%基線體重的參與者比例必須>35%,並約為安慰劑組比例的兩倍。
對於接受減重藥物治療後減重<5%的患者,在12~16周後終止藥物治療,會在那些繼續接受治療的患者中增加有臨床獲益的可能性。將開具處方的減重藥物與內科和精神科共患病的治療相統一,也可能使獲益增加。
醫師建議的減重藥物用量可能無法達到預期。患者常對較小的減重結果感到失望。對結果不滿意,以及需要支付高昂費用,可能導致藥物的短期而非長期應用。藥物治療終止後常出現體重反彈,使患者和醫師都感到沮喪。長期使用FDA批准的減重藥物,在長期體重管理中可能是必需的,正如高血壓、血脂異常和2型糖尿病必須長期用藥一樣。
減重手術
腹腔鏡下可調節胃束帶術是創傷最小、最安全的手術,該手術將可充氣矽帶置於胃底周圍,製造一個小囊袋(大約30 mL)。這一限制性手術是可逆的,不會造成胃腸解剖學變化。Y形胃旁路術通過在胃底上部製造一個與空腸Roux袢吻合的小(<50 mL)囊袋,從而限制食物攝取。食物繞開95%的胃部、十二指腸和大部分空腸。最近引入的垂直袖狀胃切除術包括切除胃的大約70%,隨後加速胃排空。
胃束帶術1年時平均減輕體重15%~20%。垂直袖狀胃切除術和Roux-en-Y胃旁路術能減輕更多體重:分別約為25%和30%。接受Roux-en-Y胃旁路術的患者中一半以上在1年時體重減輕≥25%(圖4)。
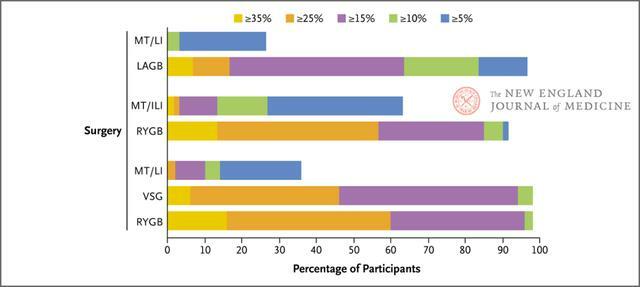
圖4. 與單獨生活方式干預相比,減重手術和生活方式聯合干預1年時的減重情況
在Roux-en-Y胃旁路術、垂直袖狀胃切除術以及胃束帶術後,人們觀察到大多數肥胖相關的健康問題——尤其是2型糖尿病,均有顯著臨床改善。6項持續時間≥2年的隨機化研究顯示,接受這些手術治療的患者糖尿病緩解率較高。如在一項為期3年的研究中,單用強化藥物治療的緩解率為5%,強化藥物治療聯合垂直袖狀胃切除術為24%,強化藥物治療聯合Roux-en-Y胃旁路術為38%。
由於腹腔鏡手術應用增多,在過去10年中所有減重手術的30日死亡率已經下降。目前胃束帶術的圍手術期死亡率最低(約0.002%),而Roux-en-Y胃旁路術和垂直袖狀胃切除術分別為0.2%和0.3%。嚴重的圍手術期不良事件與這些結果相當,約出現在1%的胃束帶術以及5%的垂直袖狀胃切除術和Roux-en-Y胃旁路術中。在≥10年的隨訪中,接受胃束帶術或Roux-en-Y胃旁路術的患者約1/4需要手術修復。
現有手術的局限性包括初始及1年時的高額費用、近期和遠期併發症危險,以及在約5%~20%患者中出現的體重反彈。然而,對於和高發病率、高死亡率以及高醫療費用相關的重度肥胖,Roux-en-Y胃旁路術和垂直袖狀胃切除術仍是迄今最有效的長期治療方法。
結論
在現代環境中創造包括預防肥胖在內的健康生活條件,對人類而言無異於一大挑戰。在治療相關患者時,僅憑醫師無法控制所有導致脂肪過量的途徑,但其可通過文中所述對患者有益的管理干預知識,推動肥胖控制。在預防和治療肥胖方面,我們需要傾注更多精力,將其作為全球公共衛生項目的一部分以控制慢病流行。
參考文獻
1. Heymsfield SB, Wadden TA. Mechanisms, pathophysiology, and management of obesity. N Engl J Med 2017;376:254-66.
2. Aronne LJ, Bramblette S, Huett-Garcia A, et al. Weight and health - pathophysiology and therapies. N Engl J Med 2022;387:e62.