口服膠囊遞送siRNA為治療需定期注射藥物的疾病提供新的策略。但是由於消化系統的障礙導致siRNA口服吸收效率低下,生物利用度低。目前仍缺乏能夠克服障礙的技術,阻礙了口服siRNA臨床應用。近日,來自蘇州大學的殷黎晨教授團隊進行了氟化小尺寸納米膠囊口服遞送siRNA抗炎治療的相關研究。研究成果以「Oral Delivery of siRNA Using Fluorinated, Small-Sized Nanocapsules toward Anti-Inflammation Treatment」為題於2022年12月27日發表在《Adv. Mater.》上。
本文開發了小尺寸氟化納米膠囊(F-NCs),介導TNF-α siRNA口服用於抗炎治療。納米膠囊具有二硫交叉連接外殼結構,在胃腸道中具有較強穩定性。小尺寸(約30納米)和碳氟化物輔助排斥粘液蛋白吸附,F3-NCs顯示出良好的粘液滲透和腸道運輸能力,而不損害腸道緊密連接,相對於靜脈注射,其口服生物利用度達到20.4%。二硫交聯劑可在目標細胞內裂解,導致NCs解體和siRNA釋放,提高TNF-α沉默效率。在小鼠急性和慢性炎症模型中,口服F3-NCs能有效抑制TNF-α,表現明顯的抗炎效果。本研究為口服siRNA傳遞提供了一項變革性策略。
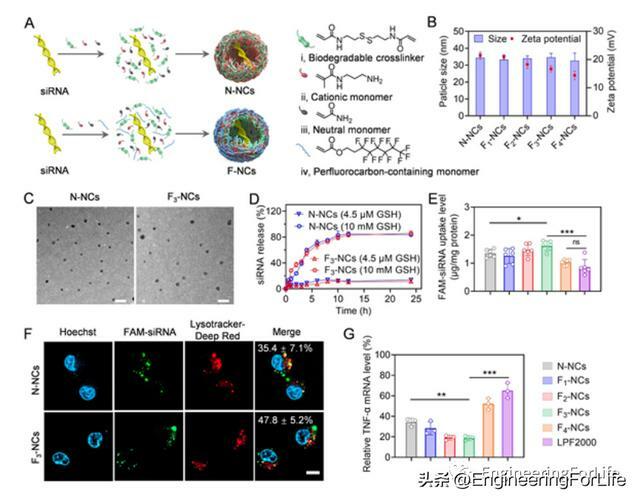
F-NCs通過原位自由基界面聚合法製備,由於siRNA具有負表面電荷,帶正電荷的單體(N-(3-氨基丙基)甲基丙烯醯胺,APm)可通過靜電作用自發聚集在siRNA周圍。含有全氟化物的單體,中性單體,都可以通過靜電作用自發聚集在siRNA周圍。然後,用過硫酸銨(APS)啟動原位自由基聚合,在siRNA周圍產生一個交聯的、可清除GSH的聚合物外殼,形成siRNA包封的Fx-NCs。
瓊脂糖凝膠電泳顯示,聚合過程中,siRNA的完整性並未受到破壞,通過動態光散射(DLS)測量。當PFA含量增加時,F-NCs Zeta電位下降,因為氟碳的引入減少NCs中陽離子氨基的相對數量。透射電子顯微鏡(TEM)觀察進一步顯示,N-NCs和F3-NCs的直徑約為25納米,大小分布均勻。siRNA穩定封裝在NCs內。PH實驗證明NCs的大小不受pH值變化的影響,無siRNA預先釋放,NCs可保護siRNA在血清、腸液和胃液中不被核酸酶水解。以上結果表明,交聯聚合物NCs對siRNA進行緊密包裹,提高GI的穩定性,避免貨物過早釋放,同時siRNA在細胞膜中有效釋放,從而提高基因沉默效率。
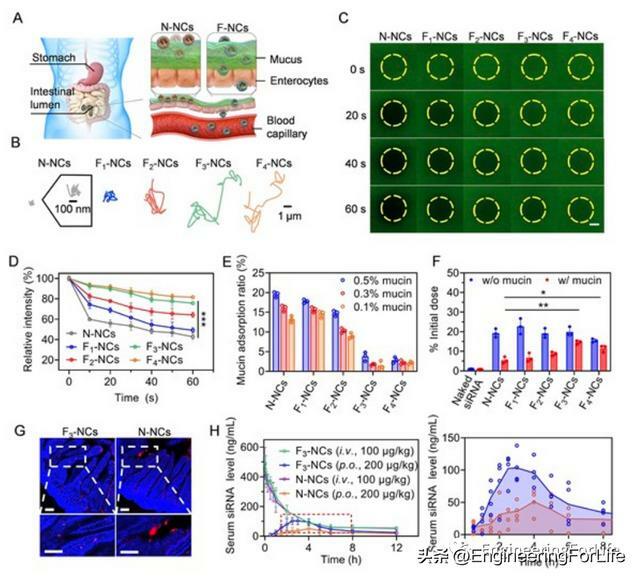
為探究F-NCs粘液滲透能力,採用多粒子追蹤(MPT)實驗評估F-NCs在新鮮小鼠腸道粘液中的布朗運動。與N-NCs相比,F-NCs表現出更強擴散能力,與氟化水平呈正相關。光漂白/恢復實驗顯示光漂白過程中黃圈內螢光強度下降與含FAM-siRNA的NCs擴散效率呈負相關。證實在NCs中加入碳氟化合物可以增強其穿透粘液的能力,主要歸因於其獨特疏水和疏脂特性,防止粘液糖蛋白吸附在NCs表面。最佳全氟碳化物含量對平衡粘液蛋白和腸細胞親和力至關重要。內吞和外吞作用事上是細胞轉運過程中兩個重要過程。研究人員研究F3-NCs在Caco-2細胞單層轉運機制,F3-NCs攝取水平在4℃或mβCD下明顯下降,表明洞室介導的內吞作用途徑。monensin和brefeldin A使F3-NCs細胞內含量分別增加到210%和190%,證實兩種途徑都參與F3-NCs外吞作用。
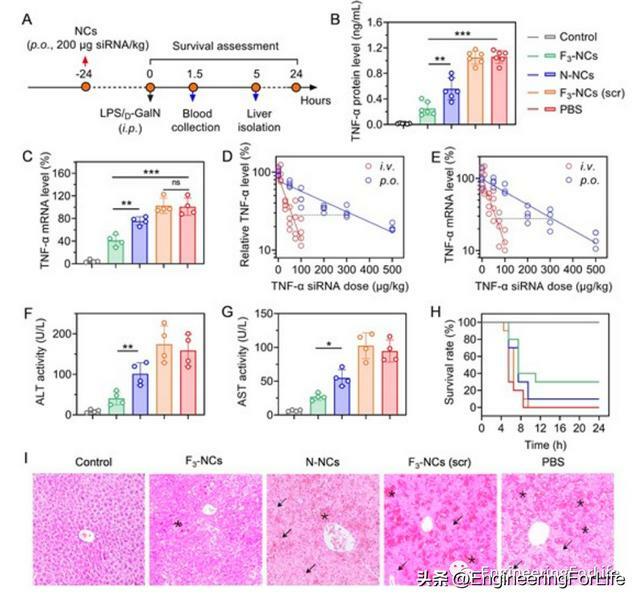
口服含TNF-α siRNA的F3-NCs在體內TNF-α沉默和抗炎作用使用TNF-α沉默小鼠進行探討。脂多糖(LPS)/D-半乳糖胺(D-GalN)用來誘發ALF。TNF-α分泌沒有被包被scramble (scr) siRNA的F3-NCs改變,表明TNF-α siRNA序列特異性沉默。對比靜脈注射或口服F3-NCs在不同siRNA劑量下下調血清中TNF-α水平和肝臟中TNF-α mRNA水平的效率發現,在TNF-α/TNF-α mRNA抑制水平為70%時,口服F3-NCs相對於靜脈注射F3-NCs的生物利用度分別為16.9%和18.7%。F3-NCs還使血清中天冬氨酸氨基轉移酶(AST)和丙氨酸氨基轉移酶(ALT)水平分別下降70%和65%,表明對肝臟損傷具有保護作用。H&E染色肝臟切片也證實F3-NCs在緩解炎症症狀方面具有顯著療效。
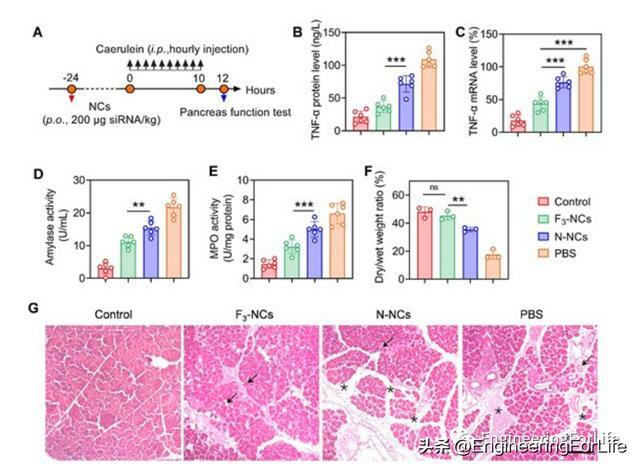
接著研究人員分析口服含TNF-α siRNA的F3-NCs對caerulein誘導AP的抗炎功效。結果顯示F3-NCs對血清中TNF-α水平和胰腺中TNF-α mRNA水平抑制率分別為65%和60%,超過了N-NCs。因此,F3-NCs降低血清中澱粉酶水平、胰腺髓過氧化物酶(MPO)活性和胰腺干/濕重量比,表明對胰腺壞死、中性粒細胞浸潤和水腫具有抑制作用。H&E染色胰腺組織的組織學分析顯示,用F3-NCs處理後,水腫、炎症細胞浸潤和胰腺壞死減少。總之,以上結果共同證實F3-NCs在減輕caerulein誘導的胰腺炎症和損傷方面具有理想療效。
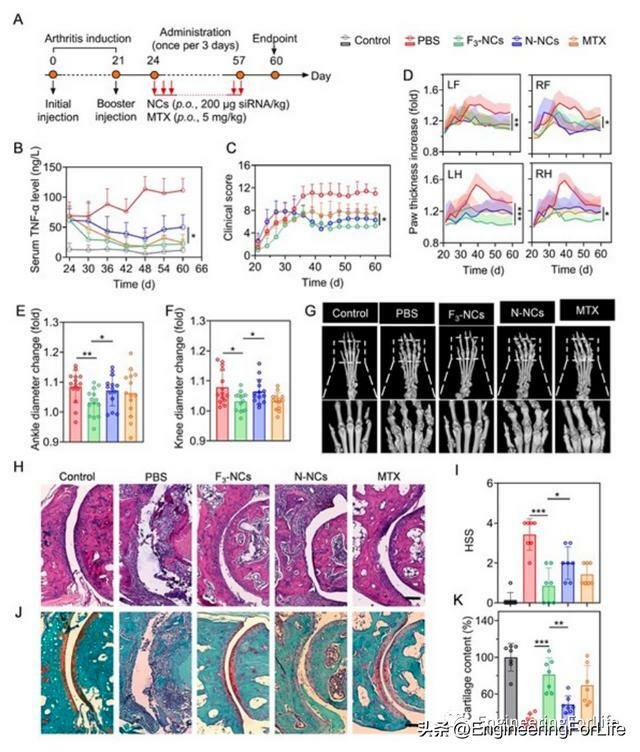
F3-NCs每三天口服200μg TNF-α siRNA/kg,可明顯在24天至60天觀察期內降低膠原蛋白誘導的關節炎(CIA)小鼠血清中TNF-α水平。口服F3-NCs後,關節炎評分下降,腫脹爪子、腳踝和膝蓋明顯縮小。相比之下,甲氨蝶呤(MTX)在TNF-α下調方面起效較慢,這是MTX在臨床上一個主要缺陷。CT掃描也顯示F3-NCs極大緩解了CIA小鼠表面骨侵蝕以及骨密度下降水平。最後,滑膜組織H&E染色顯示,F3-NCs給藥後明顯抑制滑膜增厚和粒細胞浸潤,減少了45%軟骨退化,同時增加軟骨厚度和軟骨細胞的數量。
總之,本文構建了一個高效口服siRNA傳遞系統,該系統基於氟化小尺寸、可逆交聯的NCs,能夠抵抗胃腸道內惡劣環境並同時克服腸道吸收和全身轉染屏障。可逆交聯聚合物外殼使NCs具有較高siRNA包被效率和較強穩定性。由於其小尺寸和內置全氟碳段,NCs具有強大的粘液穿透和跨上皮的吸收能力,而不損害腸道緊密連接,性能最好的是F3-NCs。相對於靜脈注射,F3-NCs具有高口服生物利用度,高效巨噬細胞中以氟化強化方式內化,二硫化物交聯裂解促進siRNA釋放並增強基因沉默。在急性炎症和慢性炎症小鼠模型中具有優異的抗炎效果。本研究為口服siRNA遞送提供了一個變革性平台,用於口服核酸有效載荷以對抗各種人類疾病。可填補口服siRNA傳遞系統的臨床空缺。
文章來源:https://doi.org/10.1002/adma.202206821
了解更多
搜索「EngineeringForLife」公眾號了解更多內容~