目前,化療和光動力療法已經成為腫瘤治療中的重要手段,兩者的聯合療法更是有助提升腫瘤的治療效果。韓國忠南大學Jae-Young Lee教授團隊開發出低氧緩解血紅蛋白(Hb)納米簇用於宮頸癌的化療-光動力PDT聯合治療。Hb與Ce6和生物素化聚乙二醇鍵合,表面吸附阿黴素(DOX),形成直徑為220 nm的蛋白納米簇NC。這些攜帶氧氣的NC,即DOX@HPBC,與天然Hb和pH響應性藥物釋放相比,在血清中表現出更好的膠體穩定性,有利於癌症治療。DOX@HPBC在缺氧培養的HeLa細胞中可以有效減輕64.8%的缺氧,並使相關生物標誌物HIF-1α和MDR1水平正常化。此外,HeLa單層和球形培養的抗腫瘤療效試驗表明,DOX@HPBC的治療效果比DOX和Ce6物理混合物提高了3.8倍,顯示出化療和PDT的協同作用。這些結果表明,DOX@HPBC具有改善缺氧的作用,降低腫瘤組織中HIF-1α和MDR1水平,並有效地向腫瘤缺氧區域遞送DOX,DOX@HPBC可能是一種有前景的化療- PDT聯合治療宮頸癌的新策略。相關工作以「Hypoxia-alleviating hemoglobin nanoclusters for sensitizing chemo-photodynamic therapy of cervical cancer」為題於2022年12月29日發表在「Chemical Engineering Journal」上。
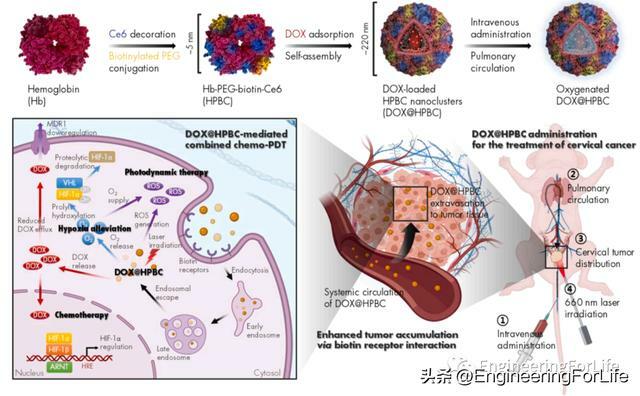
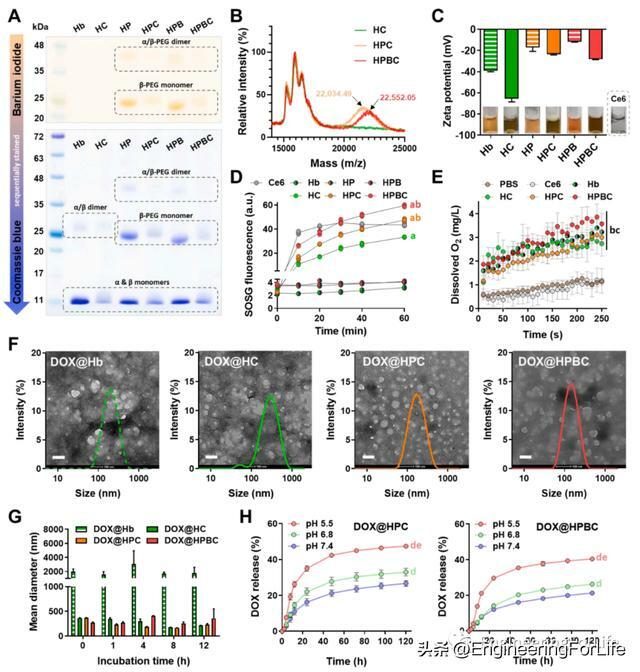
為了更好地利用Hb緩解乏氧的作用,作者假設Hb分子本身需要作為光敏劑,在時間和空間上共定位PDT和氧氣供應。Ce6通過醯胺鍵對Hb進行化學修飾,得到HC。在Ce6偶聯的樣品中,Ce6的吸收峰移至665 nm,這意味著Ce6與Hb之間形成了化學鍵。然後,HC通過β-珠蛋白單位(即Cys-93)的巰基用mPEG-MAL或生物素- PEG-MAL修飾,分別得到HPC或HPBC。通過電泳凝膠樣品的PEG和蛋白染色證實了Hb衍生物的聚乙二醇化。考馬斯藍染色顯示,在20-25 kDa和35-48 kDa的PEGylated樣品條帶上出現了新的蛋白條帶。從β-珠蛋白(~16 kDa)和PEG試劑(~5 kDa)的分子量來看,20 ~ 25 kDa和35 ~ 48 kDa的條帶可能分別來自β-PEG單體和α/β-PEG二聚體。帶子上的鋇也呈陽性碘化染色,表明PEG分子的存在。這一結果得到MALDI-TOF質譜分析的支持,其中β-PEG單體峰僅在PEG化的Hb衍生物中觀察到。質荷比約為22000,表明每個β-珠蛋白單位與PEG分子以1:1的M比綴合。Ce6和PEG的偶聯改變了Hb分子的ζ電位。所有Ce6修飾的Hb衍生物都比相應的對照組帶更多的負電荷,這可能是由於Ce6分子的自由羧酸基。此外,PEG修飾的分子相比未修飾的分子表現出更低的zeta電位,這可能歸因於PEG分子的屏蔽作用。使用SOSG試劑評估Hb衍生物的單線態氧(1O2)生產效。660 nm雷射照射下HPC和HPBC產生的1O2明顯高於HC。這一結果表明HC的聚乙二醇化可以緩解膠體不穩定性引起的自猝滅。儘管1 μg/ mL的游離Ce6在10分鐘內表現出最高的1O2生產效率,但不僅在20分鐘內觀察到飽和,而且在沒有適當的增溶劑的情況下,Ce6本身也會在體內給藥所需的更高濃度下析出。所有Hb衍生物在250秒內將DO水平提高到高於2 mg/L,顯示出與未改性Hb相當的氧釋放特徵。總之,光敏性Hb衍生物被成功製備,而不影響天然Hb的攜氧能力,DOX是一種疏水模型藥物,通過疏水相互作用吸附到Hb衍生物上,這是一種新的蛋白質結合方法,不僅是一種有效的載藥機制,而且還誘導蛋白質分子自組裝,在水環境中形成穩定的NCs。含有DOX的Hb NC,包括DOX@Hb、DOX@HC、DOX@HPC和DOX@HPBC,平均水動力直徑為230 nm,適合靜脈給藥。然而,TEM分析顯示,只有PEG修飾的DOX@HPC和DOX@HPBC呈現出均勻的球形形態,這意味著蛋白骨架的PEG修飾對於穩定的NC形成至關重要。在不同pH條件下評估PEG修飾的Hb NCs的DOX釋放模式,DOX@HPC和DOX@HPBC以持續和pH依賴的方式釋放DOX長達120小時。與pH 7.4相比,pH 5.5和6.8更易釋放DOX,這可能是由於DOX在酸性pH下溶解度增加,從而減少了藥物與Hb NCs之間的疏水相互作用。pH值5.5、6.8、7.4分別代表內溶酶體、腫瘤微環境、血腔(或正常組織),酸性條件下較高的藥物釋放量可能會增加腫瘤組織中DOX的暴露。
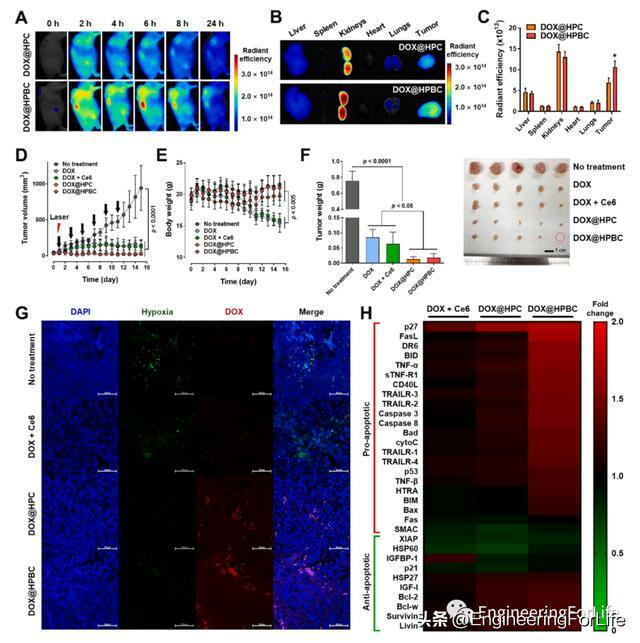
作者通過近紅外螢光成像(NIRF)評估聚乙二醇化Hb NCs的生物分布,其中用Cy5.5用於標記HPC和HPBC,製備好的NCs靜脈注射給Hela異種移植小鼠。全身掃描顯示,兩種NCs在24小時內均優先在腫瘤和腎中積累。離體成像證實了這一趨勢,腫瘤和腎臟表現出明顯高於其他器官的輻射效率值。肝臟和肺的含量極少,這表明聚乙二醇化的Hb顆粒在血液循環過程中可以分解成單個蛋白質分子。作者在HeLa腫瘤異種移植小鼠模型中評估了DOX@HPBC誘導的化療-PDT的治療效果和安全性。DOX@HPC和DOX@HPBC幾乎完全抑制了腫瘤生長,與未治療組相比,第15天腫瘤體積分別縮小了97.3%和96.6%。雖然DOX(單藥治療)和DOX + Ce6(物理混合)也能有效抑制腫瘤生長,在相同劑量下,與未治療組相比,體重在第15天嚴重下降(分別下降了28.3%和26.3%)。此外,DOX-或DOX + Ce6-治療組白細胞計數下降0.53-或0.40倍,而DOX@HPC和DOX@HPBC治療組無顯著降低。作者在組織水平上評估了所開發的NC的減輕乏氧效果及其DOX遞送效率。將DOX + Ce6(物理混合物)、DOX@HPC或DOX@HPBC (DOX和Ce6均為5mg /kg)經靜脈注射給荷瘤小鼠,每隔一天雷射照射一次,隨後給予吡莫硝唑進行缺氧示蹤。對解剖腫瘤進行的缺氧染色顯示,與不干預和DOX + Ce6治療相比,DOX@HPC和DOX@HPBC改善了腫瘤的缺氧,這與體外HG試驗一致。此外,在兩組製劑中,包括吡莫尼唑染色區域在內的整個腫瘤組織中都觀察到DOX螢光,而在DOX + Ce6組中檢測到的信號有限。這些結果支持了DOX@HPC和DOX@HPBC可以緩解腫瘤缺氧,並在體內有效地將DOX輸送到腫瘤缺氧區域的觀點。在上述化療- PDT方案後,使用抗體微陣列分析腫瘤組織中凋亡相關蛋白的相對表達模式。與未處理相比,DOX@HPBC處理導致大多數促凋亡蛋白的表達上調,包括p27(1.72±0.03)、FasL(1.67±0.09)、DR6(1.55±0.02)、BID(1.55±0.05)和TNF-α(1.53±0.02),而抗凋亡蛋白的表達呈混合模式。DOX + Ce6和DOX@HPC處理也表現出類似的模式,但變化大多小於DOX@HPBC處理。這些結果可以解釋為,與其他藥物相比,DOX@HPBC增強了DOX的積累,以及DOX隨後發揮的促凋亡作用。
總而言之,作者開發了一種新型基於化療- PDT聯合治療的藥物,可有效緩解宮頸癌的腫瘤乏氧。生物素化PEG被引入到Ce6修飾的Hb中以提高穩定性和靶向性,與未PEG化的相比,這提高了ROS的生成效率。通過將DOX加載到PEG化的Hb衍生物上,導致蛋白質分子的自組裝,產生穩定的NC。DOX@HPBC NCs通過生物素受體相互作用表現出更好的細胞攝取和球體穿透。體外驗證的增強抗癌作用和改善缺氧的潛力成功轉化為體內治療效果的改善,宮頸腫瘤顯著抑制,以及乏氧標誌物水平的改善。這些結果表明DOX@HPBC是一種很有前途的宮頸癌化療- PDT聯合治療策略。
文章來源:
https://doi.org/10.1016/j.cej.2022.141224
了解更多
圍繞醫工交叉領域,EFL建有公眾號、相關學術及產業社群,搜索「EngineeringForLife」公眾號了解更多~