AB-729是一種由加拿大楊梅生物製藥公司(Arbutus Biopharma)研發獨特的、採用專有GalNAc遞送技術針對所有B肝病毒轉錄物的單一觸發劑。在2022年末至2023年初,Arbutus公司總結了AB-729-001試驗的核心數據以及結論。
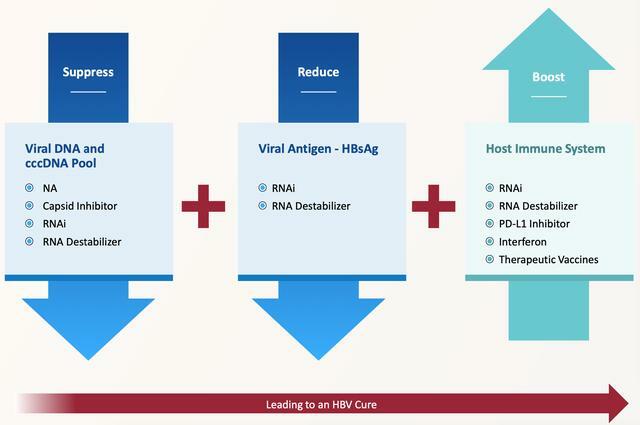
B肝在研新藥AB-729,專有GalNAc遞送單觸發劑,001試驗核心結論
AB-729-001 1a/1b期臨床試驗的第一部分和第二部分:在單次遞增劑量AB-729單一療法下,受試者的B肝表面抗原(HBsAg)和HBVDNA的水平出現雙降,AB-729單藥(90毫克單劑量)在HBVDNA+患者中取得了較好效果。
第三部分:在cHBV患者的多次遞增劑量,研究結果表明,無論劑量、給藥時間、e抗原或HBVDNA的狀態如何,HBsAg都會持續下降!治療期間與治療後HBsAg的平均降幅在各隊列中仍具有可比性。迄今為止,專門針對B肝e抗原陽性受試者隊列(隊列K)的結果進一步支持了初步觀察,表明基線e抗原狀態對反應沒有影響!
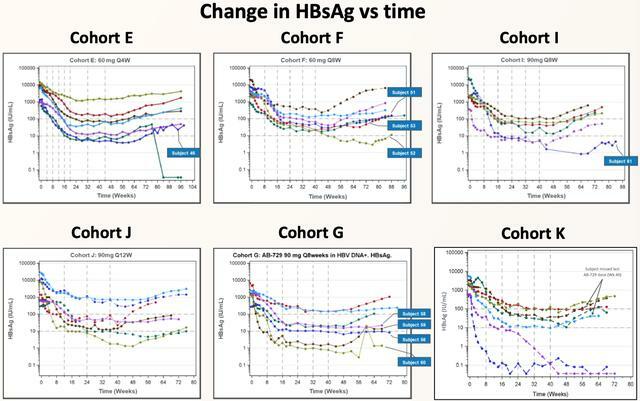
在停用AB-729後,研究人員繼續觀察到HBsAg的強勢下降依舊存在!41名中的33名受試者,在該試驗期間的某個時間點 HBsAg<100
IU/mL;隊列E中1名受試者(基線HBsAg=583.5 IU/mL)符合條件但拒絕參加NA停藥,在第84周血清轉化(HBsAg
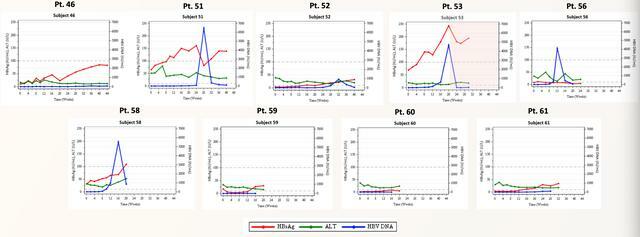
迄今為止,沒有受試者達到病毒學或臨床復發標準或重新開始使用核苷類藥物;一些受試者的HBVDNA水平出現暫時性升高,隨後在沒有干預的情況下下降。
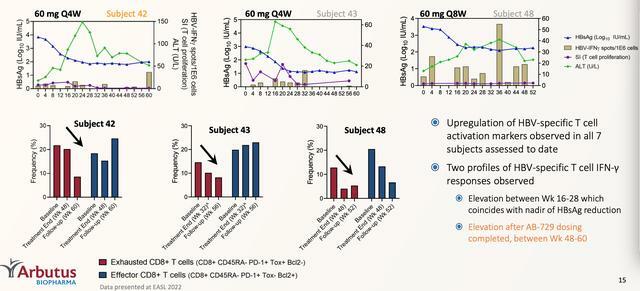
001試驗中,研究人員還觀察到,使用AB-729治療的受試者顯示出HBV特異性T細胞活化的增加和衰竭T細胞的減少,在迄今為止評估的所有7名受試者中,觀察到HBV特異性T細胞激活標誌物的上調情況以及觀察到HBV特異性T細胞 IFN-γ 反應的兩種概況。在第16至28周之間升高,這與HBsAg降低的最低點相吻合。在AB-729用藥完成後,在第48至60周之間升高。
001試驗安全性評估結果:AB-729在臨床試驗中單次與重複給藥後,普遍具有良好的安全性和耐受性,沒有治療相關SAE或因AE而中止治療情況;無治療相關的3級或4級AEs。無治療相關3級或4級實驗室異常。1級和2級ALT升高在繼續治療後得到改善或穩定,注射部位TEAEs大多較輕(紅斑、疼痛、瘀傷、瘙癢)。心電圖或生命體徵無臨床意義的變化。
AB-729-001臨床試驗主要收穫:無論劑量、給藥間隔、B肝e抗原或DNA狀態如何,AB-729都提供強有力的、可比較的HBsAg下降。停用AB-729和核苷類療法可以使HBsAg持續下降。AB-729繼續導致HBV特異性T細胞免疫的恢復和耗盡的T細胞減少。在41名受試者完成給藥後,AB-729普遍安全且耐受性良好。