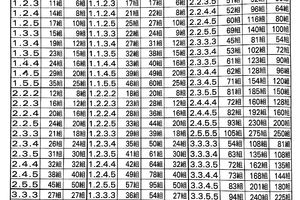
美國糞便銀行OpenBiome有一項非常誘人的獎勵制度:如果你可以一周五天不間斷捐獻出合格的糞便,便能夠在每次捐獻後獲得40美元的報酬外,額外獲得50美元全勤獎勵;而在香港的亞洲抑菌中心,每周提供3次糞便的捐獻者,每月可獲得報酬高達4800元。這並不是玩笑,糞便捐獻唯一需要的是你的糞便是萬里挑一的「健康好便」。

圖1 OpenBiome糞便捐獻標準(圖源:[1])
11 月30日,FDA(U.S. Food and Drug Administration)批准了 Rebyota,這是FDA批准的首個糞便微生物群產品,糞便療法將成現實。Rebyota 被批准用於預防18 歲及以上人群的艱難梭菌感染(Clostridioides difficile infection,CDI)復發。它適用於個體完成針對復發性 CDI 的抗生素治療後使用。

圖2 FDA批准首款Rebyota(圖源:FDA)
「今天Rebyota的批准對於護理復發性艱難梭菌感染患者來說是一項重大進步,」FDA生物製品評估和研究中心主任、醫學博士Paul Feuerstadt說道。「復發性CDI會影響個人的生活質量,也可能危及生命。作為FDA批准的第一個糞便微生物群產品,今天的批准代表了一個重要的里程碑,因為它提供了一個額外的批准選項來預防復發性CDI。」
糞便微生物藥品是救命良藥
艱難梭菌(Clostridium difficile,CD)是一種可引起CDI的細菌,CDI是一種可能危及生命的疾病,會導致腹瀉和嚴重的結腸炎症。在美國,CDI每年導致15000-30000人死亡。
腸道含有數百萬種微生物,通常稱為「腸道菌群」或「腸道微生物組」。某些情況下,例如服用抗生素治療感染,可能會改變腸道微生物的平衡,從而導致艱難梭菌繁殖和釋放毒素,導致腹瀉、腹痛和發燒,在某些情況下,還會導致器官衰竭和死亡。其他可能增加CDI風險的因素包括年齡超過65歲、因病住院、免疫系統減弱和既往CDI病史。然而CDI康復後,可能會再次感染,甚至是多次感染!這種情況被稱為復發性CDI。每次感染都會增加額外復發的風險,並且復發性CDI的治療選擇有限。糞便微生物群的管理被認為有助於腸道菌群的恢復,以防止CDI的進一步發作。
Rebyota以單劑量直腸給藥。Rebyota由合格人員捐贈的糞便製成。對捐贈者和捐贈的糞便進行了一組可傳播病原體的檢測,但是,由於Rebyota是由人類糞便製成的,因此可能存在傳播傳染原的風險。此外,Rebyota可能含有食物過敏原;該產品因食物過敏原而引起不良反應的可能性尚不清楚。
Rebyota的安全性通過兩項隨機、雙盲、安慰劑對照臨床研究以及在美國和加拿大進行的開放標籤臨床研究進行評估。參與者有一次或多次CDI復發史。他們在完成CDI抗生素治療後24至72小時接受了一劑或多劑Rebyota或安慰劑;參與者的CDI在收到Rebyota或安慰劑時得到控制。在這些研究中,978名18歲及以上的人至少接受了一劑Rebyota。在一項研究中,在180名Rebyota接受者中,與87名安慰劑接受者相比,接受一劑Rebyota後最常見的副作用是腹痛、腹瀉、腹脹、脹氣和噁心。
Rebyota的有效性在一項隨機、雙盲、安慰劑對照、多中心研究的數據分析中得到評估。該分析包括177名接受一劑Rebyota的成年人和85名接受一劑安慰劑的成年人。它還納入了另一項安慰劑對照研究的成功率,其中39名成人接受了一劑Rebyota和一劑安慰劑,43名成人接受了兩劑安慰劑。成功預防復發性CDI被定義為在服用Rebyota或安慰劑後8周內沒有出現CDI腹瀉。在一項考慮了這兩項研究的統計分析中,Rebyota組(70.6%)在8周內預防復發性CDI的總體估計成功率顯著高於安慰劑組(57.5%)。
首款糞便微生物療法Rebyota
標誌著重要的里程碑
Ferring在2018年收購了位於明尼蘇達州的開發商Rebiotix時收購了Rebyota。「我們相信這是利用人類微生物組的力量解決重大未滿足醫療需求的重大突破。這是FDA首次批准活生物治療藥物,也是數十年研究和臨床開發的結晶,」Ferring總裁Per Falk說。重要的一步有望利用我們對微生物組在人類健康和疾病中的作用的快速發展的見解,更好地理解、診斷、預防和治療許多其他疾病。」
Ferring Pharmaceuticals美國總裁Brent Ragans表示:「Rebyota是一種急需的新療法,它為每年遭受復發性艱難梭菌感染的數千人帶來了希望,Rebyota不僅有可能影響患者和護理人員,還有醫療保健系統。」
Ferring Pharmaceuticals是一家以研究為導向的專業生物製藥集團,是生殖醫學和女性健康以及胃腸病學和泌尿學專業領域的領導者。50多年來,Ferring一直致力於為母親和嬰兒開發治療方法,其產品組合涵蓋從受孕到分娩的整個治療過程。
微生物製藥商業化進程
從2007年美國啟動人類微生物組計劃開始,微生態製藥的發展進入了加速階段,一大批領先的微生物製藥明星企業開始嶄露頭角:Nexbiome、Evelo、Mikrobiomik、Seres、Rebiotix等公司,輝瑞、羅氏、輝凌等跨國製藥巨頭也開始布局微生態製藥賽道。
Seres therapeutics,美國臨床生物製藥公司,以微生物組學療法治療全球患者。研發藥物治療由微生物生態失調引發的各種疾病。Seres therapeutics探明健康和生態失調微生物組學間的差異,設計由益生菌組成的生態混合藥Ecobiotic,靶向治療功能缺陷的微生物組,並重建健康微生物生態。Seres therapeutic主打藥物SER-109,可治療艱難梭菌感染引起的腸道疾病,公司還研發治療2型糖尿病等代謝疾病的藥物。
中國,同樣湧現了不少企業,未知君生物、慕恩生物、知易生物、厭氧生物等皆有在研管線。未知君在2021年就獲得FDA臨床試驗批准,未知君FMT藥物拿到美國FDA的IND批件,意味著公司正式邁入臨床研發階段,未來公司將重點與國內多家知名醫療機構開展臨床研究合作,發力腫瘤治療、神經系統和免疫系統三大領域。
據不完全統計,全球微生態製藥公司已經超過50家,其中有30餘家累計吸金超過30億美元。
撰文|喬維鈞
排版|木子久
End
參考資料:
[1]https://designershitdocumentary.com/how-to-become-a-fecal-transplant-donor/
[2]https://new.qq.com/omn/20191022/20191022A0NY6K00.html
[3]https://www.sohu.com/a/481319363_178984
[4]https://new.qq.com/omn/20191022/20191022A0NY6K00.html
[5]https://36kr.com/p/dp2026324036889603
本文系生物探索原創,歡迎個人轉發分享。其他任何媒體、網站如需轉載,須在正文前註明來源生物探索。