
2022年2月,國家癌症中心發布了全國最新的癌症統計數據:2016年中國約有406.4萬新發癌症病例和241.35萬新發癌症死亡病例。其中,肺癌、結腸直腸癌、胃癌、肝癌和女性乳腺癌是最常見的5種癌症,占新發癌症病例總數的57.4%。報告指出,我國女性乳腺癌的發病率呈逐年上升趨勢。尤其在東部沿海地區及經濟發達的大城市,乳腺癌發病率上升更為明顯[1]。乳腺癌已經成為全世界婦女中最常見的癌症相關死亡原因。
目前,乳腺癌的主要治療方法是手術治療、放療和化療,但放療和化療常伴有包括噁心、嘔吐、脫髮、骨髓抑制等嚴重不良反應。因此,開發新的、有效的低毒藥物至關重要。作為傳統的藥用植物,人參已經受到了研究者廣大的關注。人參皂苷是人參屬植物的主要有效成分,已經在多種腫瘤的抗癌作用中被證明有效,在治療乳腺癌方面也展現了巨大的潛力。本文介紹了人參皂苷的分子類型,根據人參皂苷可以誘導乳腺癌細胞的凋亡、調節乳腺癌細胞的周期和增殖、促進乳腺癌細胞自噬、對乳腺癌中上皮細胞-間充質轉變(epithelial-mesenchymal transition,EMT)的調節等分子機制出發,歸納總結了不同類型人參皂苷抗乳腺癌的主要藥理作用及分子機制,對其進一步臨床應用具有一定的指導意義。
1 人參皂苷的分子類型
五加科植物人參Panax ginseng C. A. Mey.的乾燥根或根莖始載於《神農本草經》:「味甘微寒。主補五臟,安精神,定魂魄,止驚悸,除邪氣,明目,開心益智,久服,輕身延年」。作為我國應用歷史悠久的傳統中藥,人參在臨床上廣泛用於治療心血管、消化系統、腫瘤等疾病[2]。研究表明,人參皂苷及其代謝產物是人參發揮藥理作用的主要有效成分[3]。人參皂苷是一種固醇類化合物,易溶於水,因其振搖時可產生持久、加熱也不消失的肥皂樣泡沫,取名為「皂苷」[4]。
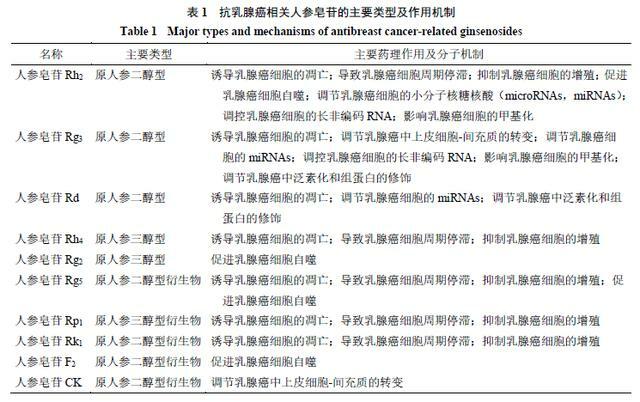
人參皂苷主要由糖分子上的半縮醛羥基和非糖類化合物上的羥基脫水縮合而成,根據皂苷元分子中四環或五環三萜達瑪烷型骨架的不同,人參皂苷主要分成3類:原人參二醇型(人參皂苷Ra1、Ra2、Ra3等)、原人參三醇型(人參皂苷Re、Rf、Rg1等)和齊墩果酸型(人參皂苷R0、Rh3、R1等)。其中,大多數人參皂苷屬於原人參二醇型皂苷和原人參三醇型皂苷[5]。具有明確抗乳腺癌活性的人參皂苷見表1,從中發現:①抗乳腺癌人參皂苷中除了原人參二醇型和原人參三醇型外,人參皂苷的次級代謝衍生物在抗乳腺癌方面也有巨大作用;②不同人參皂苷雖然都具有抗乳腺癌的藥理作用,但是不同人參皂苷發揮作用的分子信號各不相同,且分子機制複雜。為進一步對比不同人參皂苷抗乳腺癌的分子機制,根據抗乳腺癌的藥理作用,對不同人參皂苷進行了分類總結。
2 作用機制
2.1 誘導乳腺癌細胞的凋亡
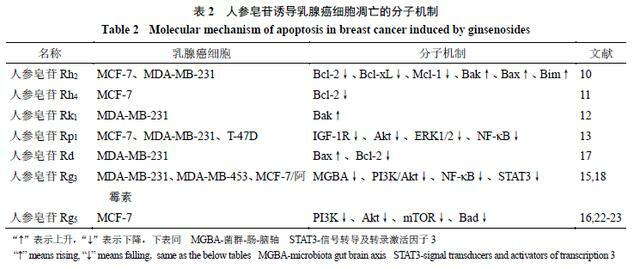
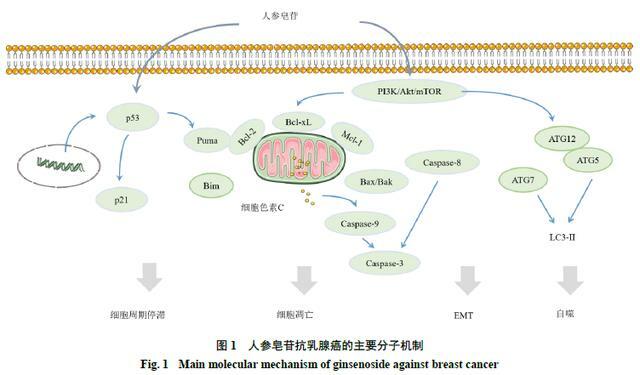
細胞凋亡是程序性細胞死亡的類型之一,也是多種抗癌藥物的重要作用機制,研究表明,細胞凋亡主要通過2種途徑:外在死亡受體途徑和內在線粒體途徑。這些途徑導致半胱氨酸蛋白酶(cysteineprotease,Caspase)的激活,這些酶可以裂解生成不同的底物,然後導致細胞死亡[6-9]。細胞調亡是人參皂苷抗乳腺癌的主要作用機制之一。目前已發現的多種人參皂苷中,包括人參皂苷Rh2、Rh4、Rk1、Rp1、Rd、Rg3和Rg5,均可誘導乳腺癌MCF-7、MDA-MB-231、T-47D細胞等的凋亡[10-16]。
研究表明,人參皂苷Rh2可顯著抑制MCF-7、MDA-MB-231細胞的增殖,這與線粒體介導的細胞凋亡有關,人參皂苷Rh2可以引起抗凋亡蛋白基因家族B淋巴細胞瘤因子-2(B-cell leukemi-2,Bcl-2)、重組B淋巴瘤細胞因子2相關蛋白-xL(B-cell leukemia-xL,Bcl-xL)和髓樣細胞白血病因子-1(myeloid cell leukemia-1,Mcl-1)的下調,還能引起促凋亡因子家族因子(Bak、Bax和Bim)的上升,導致Caspases的激活後,促進癌細胞凋亡[10]。
人參皂苷Rh4通過激活Caspase-3、Caspase-8和腺苷二磷酸-核糖聚合酶(poly ADP-ribose polymerase,PARP)蛋白水平,降低Bcl-2的表達,抑制MCF-7細胞在體內的增長[11]。人參皂苷Rk1可通過活性氧(reactive oxygen species,ROS)/磷脂醯肌醇3-激酶(phosphatidyl inositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)信號通路途徑,參與Caspase依賴的外在和內在凋亡途徑,提高Bax、細胞色素C、裂解的Caspase-3、Caspase-8和Caspase-9的表達水平,從而促進抗凋亡因子Bcl-2的水平下降,誘導乳腺癌細胞的凋亡[12]。
人參皂苷Rp1可通過胰島素樣生長因子1受體(insulin like growth factor 1 receptor,IGF-1R)/Akt信號通路誘發MCF-7、MDA-MB-231、T-47D細胞產生停滯和凋亡,從而抑制乳腺癌細胞的生長[13]。人參皂苷Rd被發現能誘導MDA-MB-231、MCF-7細胞的凋亡[14,17]。在MCF-7細胞中,人參皂苷Rd可以增加細胞的Caspase-3活性、線粒體去極化以及非G1細胞的比例,促進乳腺癌細胞凋亡[14];在MDA-MB-231細胞中,人參皂苷Rd能夠上調Bax、裂解Caspase-3、降低Bcl-2的表達,通過抑制Akt/mTOR/P70S6激酶的信號傳導,抑制細胞增殖,誘導細胞凋亡[17]。
人參皂苷Rg3通過細胞外信號調節激酶(extracellular signal-regulated kinase,ERK)和Akt的失活,以及增強鼠雙微體2基因(murine double minute 2,MDM2)與突變體p53蛋白的結合促進突變體p53的不穩定,阻斷核因子-κB(nuclear factor-κB,NF-κB)信號通路誘導MDA-MB-231細胞的凋亡[15,18-21]。人參皂苷Rg5可通過抑制PI3K/Akt信號通路,降低PI3K、Akt、mTOR和Bad的磷酸化水平,介導MCF-7細胞的凋亡,從而抑制乳腺癌細胞的增殖[16,22-23]。人參皂苷誘導乳腺癌細胞凋亡的分子機制見表2。
2.2 調節乳腺癌細胞的周期和增殖
正常細胞周期的調節過程主要由4個階段組成:G0/G1期(間隙1)、S期(DNA合成)、G2期(間隙2)和M期(有絲分裂)。在這個進程中,細胞周期的進展主要由細胞周期蛋白依賴性激酶(cyclin-dependent kinase,CDKs)調節,CDKs是參與細胞增殖的關鍵調節酶,可通過調節細胞周期檢查點和轉錄響應細胞內外信號。CDKs的催化活性可由細胞周期蛋白和CDK抑制劑(CDK inhibitor,CDKIs)的相互競爭作用決定[20-22]。作為乳腺癌的標誌物之一,抑制失控的CDKs已被認為是乳腺癌有效治療的突破口。
目前被美國食品藥品監督管理局批准用於治療激素受體陽性、晚期或轉移性乳腺癌以及其他亞型乳腺癌的CDK4/6抑制劑palbociclib、ribociclib和abemaciclib就是這種策略[24-27]。研究表明,人參皂苷Rg5、Rh2、Rk1、Rh4、Rp1也可以通過調節細胞周期對乳腺癌細胞產生抗癌作用[11-13,28-29],這些人參皂苷通過誘導乳腺癌細胞的細胞周期停滯而抑制癌細胞的增殖。人參皂苷Rh4可以促使MCF-7細胞的細胞周期停滯在S期[11]。
人參皂苷Rk1、Rg5均可以導致MDA-MB-231細胞的G0/G1細胞周期停滯[12,29]。而人參皂苷Rp1不但可以導致MCF-7細胞的G0/G1細胞周期停滯[12],還發現其可以導致MDA-MB-231、T-47D細胞的G2/M期停滯[13]。已有相關研究通過進一步的分子機制挖掘發現,人參皂苷Rg5調節MCF-7細胞周期的作用主要是通過增加p53、p21(WAF1/CIP1)和p15(INK4B)的表達,降低細胞周期蛋白D1、細胞周期蛋白E2和CDK4的表達導致的[29]。CDKs和CDKIs的調節對控制腫瘤生長至關重要[30-32],人參皂苷擁有通過調節細胞周期相關蛋白誘導細胞周期停滯的能力,這為乳腺癌的治療提供了新的有效治療的研究方向。人參皂苷調節乳腺癌細胞周期的作用機制見表3。
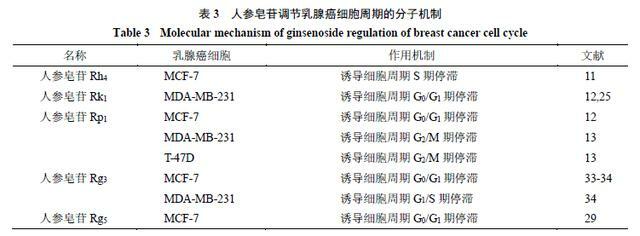
2.3 促進乳腺癌細胞自噬
除了誘導細胞凋亡和細胞周期停滯外,細胞自噬也可能是人參皂苷有效殺傷乳腺癌細胞的機制之一。作為一種程序細胞死亡,自噬相關的許多抗胸腺細胞球蛋白(anti-human thymus globulin,ATG)蛋白及其核心複合物在癌症進展和抑制方面的雙重作用仍有爭議,這些蛋白複合物(包括了ULK1/2激酶核心複合物、自噬特異性III類PI3K複合物、ATG9A轉運系統、ATG12和微管相關蛋白輕鏈3(microtubuleassociatedproteinlightchain3,LC3)泛素樣結合系統)參與自噬的啟動、成核、延伸、成熟、融合和降解。
在癌症發展的不同背景和階段,自噬發揮著動態的腫瘤抑制或腫瘤促進作用。在腫瘤發生的早期,自噬作為一種生存途徑和質量控制機制,防止了腫瘤的發生並抑制了癌症的發展。一旦腫瘤發展到晚期,建立起來並受到環境壓力的影響,自噬作為一個動態的降解和循環系統,有助於已建立的腫瘤的生存和生長,並通過促進轉移而增強癌症的侵略性[35-37]。調節自噬同樣可以作為乳腺癌治療的有效干預策略[35]。人參皂苷Rh5、Rg2、Rg3、Rh2、F2,已被證明可以通過激活自噬途徑抑制乳腺癌[16,26,38-43]。其中,體內外分析表明,人參皂苷Rh5可通過調節自噬相關ATG5、ATG12和LC3B-II的增加,以及p62蛋白表達的減少,抑制PI3K/Akt途徑,促進MCF-7細胞自噬和凋亡[16,26]。
人參皂苷Rg2可通過上調ATG7和LC3-II的水平誘導MCF-7細胞自噬[38,41]。人參皂苷Rh2可以降低同源性磷酸酶張力蛋白誘導的激酶1[phosphatase and tensin homologue (PTEN)-induced putative kinase 1,PINK1]和帕金森病蛋白(Parkin)的表達,增加過氧化物酶體增殖物激活受體-γ共激活因子-1α(peroxisome proliferators-activated receptor γ coactivator-1α,PGC-1α)的表達,減少有絲分裂,調節活性氧和線粒體自噬,抑制MCF-7細胞增殖[39]。人參皂苷Rg3能顯著抑制MCF-7細胞的增殖,主要通過MCF-7細胞的自噬產生作用[42]。人參皂苷F2通過調節p53介導的凋亡途徑,同時誘導酸性泡狀細胞器的形成,將綠色螢光蛋白-LC3-II招募到自噬體中,提高ATG-7水平,刺激乳腺癌幹細胞的自噬[43]。人參皂苷促進乳腺癌細胞自噬的分子機制見表4。
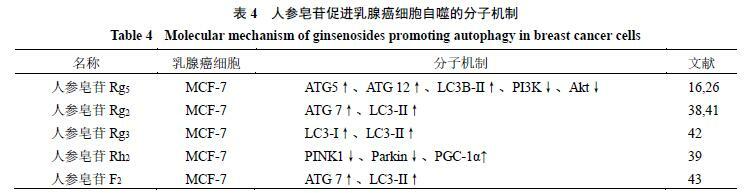
2.4 對乳腺癌中EMT的調節
EMT是一種生理和病理現象,可以影響細胞間上皮特徵的喪失和獲得,在腫瘤細胞的侵襲和轉移中扮演了重要角色[44]。上皮細胞呈柱形或立方形,極性較強,細胞與細胞之間連接緊密,不運動,按線狀成排覆蓋在黏膜表面上,當受到外部因子刺激後,上皮細胞可以通過一系列生長因子和細胞因子誘導轉變成沒有極性的、運動能力較強的間質表型特性細胞,在這個EMT過程中,上皮細胞的形態逐步變成紡錘樣纖維形,細胞極性減弱甚至喪失,細胞黏附性較差,細胞鬆散,容易轉移[45]。
鋅指轉錄因子、細胞轉型調控因子和E盒結合鋅指蛋白等轉錄因子對EMT的調控,以及EMT的誘導,通過轉化生長因子-β(transforming growth factor-β,TGF-β)、絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和NF-κB信號通路增強了轉移的可能性[46]。研究表明,EMT在乳腺癌的遠處轉移中發揮關鍵性作用[47-48],人參皂苷Rg3、Rb1、CK等可通過干預EMT有效阻止乳腺癌的發生和發展。
人參皂苷Rg3在小鼠乳腺癌FM3A細胞中通過調節骨髓源性抑制細胞,抑制STAT3依賴性途徑、腫瘤源性細胞因子和跨膜受體NOTCH信號通路,阻礙EMT的發生,有效控制乳腺癌的進展[49]。人參皂苷CK可通過PI3K/Akt途徑抑制MCF-7細胞的增殖和EMT,並誘導乳腺癌細胞凋亡[50-51]。人參皂苷Rb1可通過抑制MDA-MB-231細胞EMT和受體酪氨酸激酶樣孤兒素受體1(receptor tyrosine kinase like orphan receptor 1,ROR1)表達來減緩乳腺癌的發生、發展[52]。這些研究也均表明抑制EMT也是人參皂苷發揮作用的重要機制。人參皂苷抗乳腺癌EMT調節的分子機制見表5。

人參皂苷抗乳腺癌的主要分子機制見圖1。
2.5 其他
2.5.1 調節乳腺癌中miRNA
miRNA是長度為18~25 nt的非蛋白編碼的小型RNA,通過調節其目標mRNA的降解和抑制翻譯來發揮基因調節器的功能[53]。在癌細胞中,miRNA可以通過調節各種信號通路來影響細胞的凋亡、增殖、轉移、EMT和腫瘤的發生[54-56]。Wang等[57]研究發現人參皂苷Rd可以降低小鼠乳腺癌4T1細胞中miR-18a的表達,下調大鼠信號轉導分子2(signal transducer 2,Smad2)的表達水平,抑制乳腺癌細胞的增殖、轉移和侵襲。
Wen等[58]研究發現人參皂苷Rh2可以通過調節MCF-7細胞中miRNA-222、miRNA-34a、miRNA-29a的表達,逆轉化療藥物多西紫杉醇或阿黴素對乳腺癌的耐藥性。Park等[59]研究認為人參皂苷Rh2通過控制突觸融合蛋白結合蛋白5-AS1/miR-4425/新型E3泛素連接酶信號通路來抑制MCF-7細胞生長。Kim等[60]研究表明人參皂苷Rg3通過控制長非編碼RNA(long non-coding RNA,lncRNA)ATXN8OS和miRNA-424-5p信號通路來抑制MCF-7細胞的增殖並刺激其死亡。
2.5.2 調控乳腺癌中lncRNA
lncRNA是一種200 nt以上的RNA,具有與外顯子結構、RNA聚合酶II的轉錄處理和中間mRNA相同的特徵。乳腺癌患者的預後與免疫細胞的浸潤與lncRNA的表達密切相關[61-62],人參皂苷Rg3、Rh2可以通過調節lncRNA的表達,抑制乳腺癌細胞的增殖、遷移和侵襲。
人參皂苷Rg3可以抑制乳腺癌細胞的增殖,這可能是通過調控MCF-7細胞中的2個lncRNA的啟動子STXBP5-AS1和DNA結合調節因子X3(regulatory factor X3,RFX3)-AS1,影響STXBP5、代謝型穀氨酸受體1(recombinant glutamate receptor metabotropic1,GRM1)、RFX3和溶質載體家族1成員1(solute carrier family 1 member 1,SLC1A1)基因的表達[63],也可能是通過控制lncRNA(ATXN8OS)[60]來實現的。人參皂苷Rh2抑制MCF-7細胞的擴增與lncRNA的啟動子STXBP5-AS1[59]和3號染色體開放閱讀框67抗體(chromosome 3 open reading frame 67,C3orf67)-AS1[64]相關。
2.5.3 影響乳腺癌的甲基化
表觀遺傳調控改變了遺傳密碼,通過誘導癌症的基因型變化而影響表型。修飾是由甲基化、組蛋白修飾和miRNA等組成。表觀遺傳學修飾導致腫瘤基因的激活和腫瘤抑制基因的失活,已被認為是診斷癌症的新標誌[65]。通過甲基化高低的變化,人參皂苷Rh2、Rg3可以抑制乳腺癌細胞的惡性增殖。Ham等[66]研究發現,人參皂苷Rg3抑制MCF-7細胞是通過高甲基化的1號染色體開放閱讀框25抗體、ATP酶蛋白酶體26S亞基6和人NADPH氧化酶4,低甲基化的人α-2,3-唾液酸轉移酶、腎胺酶基因和人賴氨酸特異性脫甲基酶5A來實現的。Lee等[67]研究發現人參皂苷Rh2抑制MCF-7細胞的生長與高甲基化Caspase-1和小鼠胰島素樣蛋白5基因,低甲基化人嗅覺受體52家族成員1基因相關。
2.5.4 調節乳腺癌中的泛素化和組蛋白修飾
泛素化是指泛素(一類低相對分子質量的蛋白質)分子在一系列特殊的酶作用下,將細胞內的蛋白質分類,從中選出靶蛋白分子,並對靶蛋白進行特異性修飾的過程。這些特殊的酶包括泛素激活酶、結合酶、連結酶和降解酶等。蛋白質泛素化通過調節細胞周期停滯,影響腫瘤細胞的增殖、遷移、侵襲、發生和發展[68]。Zou等[69]研究發現人參皂苷Rg3可以調節MDA-MB-231細胞中13個位點的磷酸化狀態,抵制乳腺癌的進展,調節的這些磷酸化蛋白包含了E3泛素蛋白連接酶MYCBP2和E3 SUMO蛋白連接酶RAN結合蛋白2。Pokharel等[70]研究發現人參皂苷Rd與多柔比星耐藥MCF-7/ADR細胞中多藥耐藥蛋白1(multidrug resistance 1,MDR1)的泛素化增加有關。MDR1的穩定性可以通過泛素化進行下調,而人參皂苷Rd可通過泛素化降低了MDR1的蛋白表達,增加了多柔比星的敏感性。
3 人參皂苷協同其他化療藥物聯合治療對乳腺癌的影響
人參皂苷聯合常規化療藥物的抗乳腺癌具有協同作用。Zhang等[71]研究發現人參皂苷Rd可以通過MAPK/NF-κB途徑,降低多柔比星耐藥MCF-7/ADR細胞誘導的ATP結合盒B1抑制劑的表達水平,抑制多柔比星外流,同時還能抑制NF-κB與人類MDR1啟動子的結合,改善多柔比星的藥動學,減少其抗藥性。Hou等[72]研究證實人參皂苷Rh2在暴露於多柔比星的MDA-MB-231細胞中對抗乳腺癌的效果是緩解衰老相關的分泌表型(senescence-associated secretory phenotype,SASP)。研究發現由多柔比星誘導的SASP激活而遷移和侵襲的細胞,可以被人參皂苷Rh2通過p38 MAPK、NF-κB信號和STAT3途徑抑制。
Yuan等[73]研究發現在MDA-MB-231細胞中,人參皂苷Rg3聯合紫杉醇比單用紫杉醇可以大大降低乳腺癌細胞中Bcl-2蛋白的表達,並顯著提高Bax和Caspase-3的表達,人參皂苷Rg3通過調節Bax/Bcl-2和抑制NF-κB信號通路在激活紫杉醇的細胞毒性和誘導細胞凋亡的作用中發揮關鍵作用。Zhang等[50]研究發現人參皂苷CK和順鉑都能抑制MCF-7細胞的增殖、EMT和誘導細胞凋亡,而且人參皂苷CK和順鉑聯用可以增強作用效果,其分子機制主要與PI3K/Akt信號通路相關。Pokharel等[70]研究發現人參皂苷Rd與多柔比星耐藥MCF-7/ADR細胞中MDR1的泛素化增加有關。
4 結語
乳腺癌是全球婦女最常發生的癌症。根據荷爾蒙受體的表達,它被分為4個基本類型。包括雌激素受體陽性、孕激素受體陽性、人類上皮生長因子受體2陽性和三陰性乳腺癌。乳腺癌的治療方法是手術治療、放療和化療。人參皂苷作為一種天然的抗腫瘤活性成分,在治療乳腺癌方面展現了廣闊的應用前景,抑制乳腺癌的分子機制主要包括促進細胞凋亡、影響細胞周期、誘導自噬、調節EMT、表觀遺傳變化和聯合治療等。特別是,有研究發現人參皂苷的抗癌作用可以影響它們與傳統化療相結合的問題。
化療是利用藥物殺傷癌細胞,在乳腺癌的臨床中是常用的治療方式。由於化療對腫瘤細胞並沒有特異性,這種方式在殺傷腫瘤細胞同時也會殺傷正常細胞,從而會導致一系列的噁心、腹瀉、嘔吐、脫髮等不良反應。但是,人參皂苷聯合化療的使用為乳腺癌的治療提供了一種新穎的潛在治療方式,為未來在臨床治療中減少傳統化療對抗乳腺癌產生的不良反應提供了新的思路。
本文綜述了人參皂苷抗乳腺癌的分子機制,發現目前人參皂苷在乳腺癌方面的的研究更多的是基於乳腺癌細胞系開展的,這些乳腺癌細胞系主要是MCF-7、MDA-MMB-231、T-47D細胞。人MCF-7細胞來自一名69歲的乳腺癌白人女性患者的胸腔積液內的細胞。該細胞系保留了乳腺分化上皮的特徵,可表達癌基因Wnt蛋白家族7B抗體(protein Wnt-7b,WNT7B),並能通過胞質雌激素受體加工雌二醇並能形成隆突結構,同時,腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)可以抑制MCF-7細胞的生長,抗雌激素處理能調節細胞胰島素樣生長因子結合蛋白的分泌。
人MDA-MB-231細胞來自一名51歲的乳腺癌白人女性患者的胸腔積液內的細胞,該細胞可表達表皮生長因子(epidermal growth factor,EGF)受體、TGF-α受體和癌基因WNT7B,是一種常用的三陰性乳腺癌模型細胞系。人T-47D細胞是來自一名54歲女性患者侵入性乳房導管癌的胸腔積液內的細胞,可表達癌基因WNT7B,有細胞質連接、可表達17β-雌二醇及其他類固醇激素、降鈣素的受體。
細胞水平的研究雖然提供了很好的平台並明確了人參皂苷的抗乳腺癌作用,但是,細胞水平的模型結構較單一,不能完全代表乳腺癌的特徵,缺乏足夠的動物水平、人體水平的研究。這也主要是因為低等動物或高等動物水平缺少足夠的研究模型,而人體水平還未達到應有的研究等級導致的,這其實是目前人參皂苷在抗乳腺癌治療研究方面的難點。如何進一步明確人參皂苷抗乳腺癌的作用,推動其臨床前、甚至開展相關臨床研究,以治療原發性和轉移性乳腺腫瘤,還需要科研工作者繼續努力探討。
利益衝突 所有作者均聲明不存在利益衝突
參考文獻(略)
來 源:徐子晨,范子祥,王文倩,孟 帥,崔海燕,朱明宇,王婧斯,張 魯.人參皂苷抗乳腺癌分子機制的研究進展 [J]. 中草藥, 2022, 53(20): 6601-6610 .