重症行者翻譯組 梁艷 譯
摘要
輸液給藥是危重病人治療的基石。本文的目的是重新評價輸液給藥的病理生理學,包括了與流量和壓力指標交互作用有關的機制,對休克綜合徵的全身反應,不同類型的液體的影響和前負荷依賴的反應性概念。在這種情況下,前負荷、每搏量(SV)和輸液給藥之間的關係如下:輸注的液體量必須足夠大,才可增加靜脈回流的驅動壓,從而增加心臟舒張末期容積,只有當左右兩心室的功能狀態都在處於Frank-Starling曲線的陡峭部分時,舒張末期容積的增加才會導致SV的增加。因此,液體應該被當作藥物來看待,液體的給藥劑量和給藥速度對最終結果均有影響。根據總輸液量的滴定式液體治療,同時也應關注所使用的液體類型是液體復甦的一個重要組成部分。目前尚沒有一個單一的、可靠的、可行的生理或生化指標可用來確定SV變化和氧輸送之間的平衡(即耦合「宏觀」循環和「微」循環),這使得急性循環功能障礙的診斷主要是根據臨床上的診斷。
小結
– 液體是用於休克患者以增加其心輸出量的藥物,目的是改善對細胞的氧供。對液體給藥的反應是由心功能和靜脈回流的生理交互作用決定的。在膿毒症休克中,液體給藥的有益臨床反應在幾小時後迅速減少,液體給藥量的滴定對避免有害的液體過負荷至關重要。液體衝擊是以一定的速度把一定的液體量快速給患者輸注,以評估其液體反應性。
– 危重病人理想的液體並不存在;但晶體應作為首選。平衡晶體溶液可能與更好的預後有關,但證據級別仍然很低。對於已經進行了液體復甦,並且有液體過負荷風險的患者,輸注白蛋白可能有用。
- 液體給藥被整合到壓力和流量這些「宏觀」血流動力學指標的複雜管理中,並與「微觀」局部組織流量分布和局部新陳代謝結合。宏觀指標是通過測量全身血壓和評估整體心功能來管理的。細胞的氧供臨界閾值很難估計,但可以考慮把一些指標和臨床體徵作為其替代指標,並整合到床旁決策流程中。
背景
輸液給藥是危重病人治療中最常見但也是最有爭議的治療干預之一。更有爭議的是如何評估和管理對液體給藥的反應(根據流量和壓力指標),從平常的「僅僅輸液」到快速液體衝擊,再到補液藥前先評估患者對液體的反應性,最後是基於機器學習和人工智慧的旨在個體化使用液體治療的最新方法。
許多ICU患者都會發生休克,休克表現為一種危及生命的臨床狀況,需要及時識別和治療,以提供足夠的組織灌注,從而向細胞提供足夠的氧。一項對1600多名因休克而進入ICU並需要血管升壓藥的患者的大型試驗表明,膿毒症休克是最常見的休克類型,發生在62%的患者中,而心源性休克(16%)、低血容量性休克(16%)和其他類型的分布性休克(4%)或梗阻性休克(2%)較少發生。該綜合徵的進展與線粒體功能障礙和細胞信號通路的失調有關,可導致多器官損害和衰竭,最終導致無法治療的血流動力學不穩定和死亡。
休克的最佳治療是存在時間依賴性的,需要及時和充分的液體和/或血管升壓藥的聯合支持治療。由多項生理學和臨床研究得出的有力證據支持的基本原理就是改善氧供(DO2),從而滿足全身的氧需求。氧供被定義為血氧含量和心輸出量(CO)的乘積。病理性細胞氧耗是由於組織氧需求超過DO2或組織不能利用O2。在過去的幾十年中,我們對休克機制的認識有所提高,臨床實踐從過去「一刀切」政策轉向個體化治療。
對於急性循環衰竭的危重病人,補液是一線治療,目的是增加靜脈回流、每搏量(SV),從而增加CO和DO2。液體復甦後CO的增加對血壓的影響不是線性關係的,而是與基線條件有關(參見"Fluids and ICU outcomes: does thetype of fluid matter?")。
Thomas Latta 在1832年給《柳葉刀》編輯的一封信中首次描述了應用液體復甦技術來治療休克發作。他多次給一位老年女性患者輸注晶體液,觀察到第一次注射後沒有產生任何臨床相關的效果;然而,在多次注射(總共2.8升)後,「以下這些很典型的,眼睛凹陷,下巴下垂,蒼白而冰冷,標誌著死神印記的特徵,開始發生轉變,煥發出活力來;手腕上重新出現了脈搏」。這位女士最終就是文獻報導的第一位液體治療應答者。
這是個極有說服力的例子,講述了幾個生理和臨床問題,這些問題在近200年後今天仍然有效:
CO是心功能(由Otto Frank和Ernest Starling在100多年前的觀察描述)和靜脈回流(基於Guyton提出的靜脈容量血管的彈性回縮、容量擴張靜脈、靜脈順應性和靜脈系統阻力之間的關係)生理交互作用的因變量。存在液體反應性表明患者的心臟在Frank-Starling心功能曲線的陡峭部分運行,而不存在液體反應性則出現在曲線的平台部分,前負荷的增加不會進一步增加CO。Latta醫生治療的女士對第一次液體注射沒有反應,可能是因為輸注的液體量還不足以增加靜脈回流(即引起與靜脈順應性相關的張力性容量的變化)。因此,輸液量是一個至關重要的因素。最新的拯救膿毒症運動指南再次建議對膿毒症患者給予至少30ml/kg體重的初始液體量,這被認為是安全有效的平均目標量。然而,由於液體治療的目標是增加SV,從而增加CO,只有當患者的心功能尚未達到曲線的平台時,才應給予輸液。事實上,甚至可能在達到曲線平台這一點之前,不能增加CO的液體給藥都可以被認為是徒勞。液體衝擊(FC)是一種血液動力學診斷測試,快速給予輸注一定量的液體,目的是識別存在液體反應性的患者,在液體輸入時CO隨之增加。這種方法使得液體治療可以進行個體化滴定,並降低液體過負荷的風險,這會影響患者的臨床結局和死亡率。
在臨床實踐中,對FC之後出現有益的臨床反應的可能性,隨著膿毒症休克復甦開始數小時後很快就降低,在沒有血流動力學監測和復甦目標(即CO增加到預定閾值以上)的前提下,這使得液體治療的優化相當複雜。
對於有液本反應性的休克患者,在給予液體治療後常伴隨著明顯的器官灌注恢復的跡象。因此,自1832年以來,在休克期間給予輸液並在床邊觀察患者的臨床改善情況被證明是合理的。目標很重要嗎?尚沒有一個單一的臨床或實驗室指標可以簡單地反映組織灌注狀態。因此,提出了一種多模態評價方法。當確定一個指標作為液體復甦的潛在觸發指標或目標指標時,應考慮幾個方面,但最重要的是,該指標必須是流量敏感性的。這意味著需要選擇一個對全身血流量和/或灌注壓的增加表現出幾乎實時響應的指標,並且可能適合於評估快速治療的效果的,例如在非常短的時間內(例如,15分鐘)進行快速液體輸注。持續性高乳酸血症可能不是一個啟動液體治療的充分的觸發因子,因為它有多種原因所致,包括一些在許多患者中與灌注無關的原因[例如:腎上腺素能亢進或肝功能障礙],因此,一味地追求乳酸正常化可能會增加液體過負荷的風險。事實上,最近的一項研究顯示,在最終存活的膿毒症休克患者隊列中,50%的患者血乳酸水平仍然是升高的。相反,一些流量敏感性指標,如:外周血灌注、中心靜脈血氧飽和度、中心靜脈-動脈二氧化碳分壓差等指標,幾乎80%的患者在2小時內恢復正常。以毛細血管再充盈時間(CRT)為代表的外周灌注指標,似乎是一個符合生理學的,可以作為液體復甦的觸發因子和復甦目標。大量有力的證據證實,在早期或晚期復甦後出現的外周灌注異常,與發病率和死亡率的增加有關。皮膚濕冷、花斑和CRT延長被認為是膿毒症休克患者液體復甦的觸發因素。此外,正常的CRT(或CRT恢復正常)與良好的預後相關、對液體負荷的反應時間快、簡單易行、在資源匱乏的情況下也可行、與生理相關區域(如肝內臟局部)的灌注平行變化的能力,這些都是強烈支持將CRT作為膿毒症休克患者液體復甦目標的理由。最近的一項大型隨機對照試驗(RCT)表明,以CRT為導向的復甦與以乳酸為導向的復甦相比,死亡率更低,器官功能障礙更少,治療強度更低,包括復甦液量更少。膿毒症休克的特點包括血管張力降低,影響小動脈和小靜脈,產生心肌抑制,局部血流分布和微血管灌注改變,血管通透性增加。此外,宏觀循環、微循環均受到生理學上的調節,以維持平均動脈壓(MAP),使CO能夠滿足局部組織血流分布,這與局部代謝有關。從臨床的角度來看,一旦器官灌注達到正常,再通過補液或給予血管升壓藥來增加宏觀血流動力學指標(MAP和CO)的理由是相當弱的。
Latta醫生治療的這位女士「手腕恢復脈搏」,提示著流量和壓力在其體內發生了關聯。在日常實踐中,低血壓經常被用來觸發啟動液體治療。MAP目標也被許多ICU醫生用作停止補液的指標。這一假設在許多方面是有缺陷的。首先,把MAP恢復到預定目標之上並不一定意味著能逆轉休克;同樣,MAP值低於預先設定的閾值並不一定意味著存在休克。其次,更重要的是,SV的變化與MAP的變化之間的生理關係並不直接相關,而是取決於血管張力和動脈彈性。在高血管舒縮張力的患者中,輸液後SV的增加將與MAP的增加相關。這在單純低血容量的患者中非常典型,如失血性休克患者,對出血的生理反應包括嚴重的靜脈和動脈收縮。在低血管舒縮張力的患者中,如膿毒症和深度麻醉期間的患者,儘管在補液後SV可能顯著增加,但MAP幾乎沒有變化。MAP與SV之間缺乏明顯的相關性已在許多ICU患者中被證實,尤其是在膿毒症休克期間。有趣的是,動態動脈彈性(用呼吸導致的脈壓變化值除以SV的變化值來進行計算)可以用來識別那些可能因其對體液有反應而增加MAP的患者,但這需要特定的監測工具。最後,我們應該記住,液體給藥的主要目的是增加組織灌注,因此,輸液後MAP的變化被認為是有益的,但不應被當作液體治療的主要目標。
由於人體生理學在幾個世紀以來一直保持一致,流量和壓力相互作用的機制、這些變量對休克綜合徵的系統反應、液體治療的效果以及前負荷依賴性和前負荷反應性的概念就仍然有效。本文旨在將這些物理概念與ICU患者液體治療的三個主要病理生理學方面的最新進展相結合。
液體衝擊、液體推注和液體輸註:給藥速度有關係嗎?
根據Frank-Starling定律,前負荷(舒張末期跨壁壓)與其所產生的SV之間存在曲線關係,而SV受心肌收縮力狀態的影響(對於給定的前負荷,心肌收縮力增強會增加SV,反之亦然)。該曲線可分為兩個部分:(1)陡峭的部分,在該區域內前負荷略有增加就可導致SV顯著增加(前負荷依賴區);(2)平坦的部分,在該區域內SV受前負荷變化的影響最小或不受影響(前負荷非依賴區)。
所描述的前負荷、SV和液體給藥之間背後的生理學聯繫是,輸注的液體量必須足夠多,以增加靜脈回流的驅動壓,只有當左右兩個心室都處在Frank-Starling曲線的陡峭部分時,舒張末期容積的增加才會導致SV的增加。因此,可以將FC定義為有效地衝擊系統所需的最小液體容量。因此,在循環系統休克復甦時輸液的唯一原因就是提昇平均系統壓,以增加靜脈回流的驅動壓(定義為平均系統壓減去右房壓),正如最近一項前瞻性研究所見,該研究探討了膿毒症患者對復甦反應的心血管決定因素。如果給予的液體量足夠多和輸注速度足夠快,大多數FC將會增加平均系統壓,如下所述。然而,右房壓的同時增加表明受試者沒有容量反應性,他們的前負荷反應狀態需要重新評估。
把FC當作一種藥物(例如:應用藥效學方法來研究其反應性)已成為少數幾項研究的主題。第一項小型研究是由Aya在術後患者中進行的,證實了有效的FC所需的最小液體量為4ml/kg。但在文獻報導中,絕大多數對ICU患者液體反應性和FC反應領域的研究都採用500ml液體量(平均),對絕大多數ICU患者來說,所給液體量遠大於4 ml/kg。有趣的是,在FENICE研究中(一項包括46個國家311個中心的觀察性研究),500ml液體也是臨床實踐中補液量的中位數,而較低的平均容量(250ml)則通常用於接受目標導向治療優化的高風險的外科患者。這一差異可能暗示了更大的快速補液量通常不僅用於評估液體反應性,也用於治療血流動力學不穩定的發作,提示了液體給藥的治療效果。然而,反覆給予快速補液可能會增加液體過負荷的風險,在進行FC之前進行液體反應性預測也是一個關鍵點,不幸的是,這顯然還存在很大的困難。事實上,在臨床實踐中採用的幾種床邊可觀察到的臨床體徵、系統壓力和靜態容量指標,對FC補液效果的預測性較差。為了克服這些局限性,床旁功能性血流動力學評估已越來越流行,包括影響心功能和/或心肺交互作用的操作,這些操作手法可引起隨後的血流動力學反應,其反應程度在液體應答者和非應答者之間會有所不同。
最近,與FC給藥有關的各個方面都已有相關研究,表明補液量、補液速度和定義液體反應性的閾值對FC的最終結果均有影響。一項RCT顯示,FC補液的持續時間對液體反應性的比例有影響,同樣是4 ml/kg體重的液體量,輸注時間10分鐘的FC出現液體反應性的比例為51.0%,而輸注時間為20分鐘的FC僅有28.5%的液體反應性。然而,這項研究是在血液動力學穩定期的神經外科手術患者中進行的,這就限制了其結果延展到不同外科疾病患者或危重患者中的有效性。
在不使用FC技術的情況下給予快速輸注液體時,最佳輸液速度是多少?人們認為,由於靜水壓力不會突然增加,較慢的流速可能會限制血管滲漏。最近,一項大型多中心試驗將10520名患者隨機分為兩組:一組是以符合當前治療標準的輸液速度接受輸液[輸液劑量為500ml,時間約為30分鐘,即輸液泵輸液速度的上限(999ml/小時;16ml/分鐘)],另一組是以較慢的輸液速度(333ml/小時;5.5ml/分鐘)接受輸液,後者輸液速度比FENICE隊列研究中小於25%。重要的是,本試驗採用的輸液速度總體上比採用FC技術來糾正血流動力學不穩定的臨床研究的輸液速度(即:10分鐘內輸500ml=50ml/分鐘;20分鐘內500ml=25ml/分鐘)要慢,這表明作者應用了快速液體輸注,只是用了不「正確」的速度。兩組在ICU住院期間的主要結果(90天死亡率)和所有次要臨床結果均無差異,提示持續補液擴容的輸液速度並不影響臨床結果。這並不出乎意料,因為只有給藥輸液速度不同,而液體總量相同,兩組中存在容量反應的患者比例可能也是相似(即使沒有監測,根據大組隨機化的效果,這一比例被認為相同)。
液體和ICU預後:液體的類型重要嗎?
對於休克患者,理想的液體成分應與血漿相似,以促進細胞代謝,避免器官功能障礙,並能夠實現血管內容量的持續增加,以優化CO。不幸的是,並沒有理想的液體存在。可供選擇的液體大致分為三類:晶體類、膠體類和血液製品。後者幾乎沒有非常具體的輸注指征,包括創傷患者的休克和失血性休克,不在本文討論。
膠體是由大分子組成,可以在血管內停留幾個小時,增加血漿滲透壓,減少對液體的進一步需求。儘管它們存在理論上的優勢,但膿毒症患者常常存在糖萼改變和內皮通透性增加,這可能導致膠體大分子外滲,增加全身滲漏綜合徵的風險,並抵消了膠體的主要優勢。膠體又分為半合成膠體和白蛋白。半合成膠體包括羥乙基澱粉、右旋糖酐和明膠,它們要麼沒有效果,甚至給危重病人帶來有害的後果,增加急性腎損傷(AKI)的風險。因此,半合成膠體在休克患者中的應用應該被拋棄。
白蛋白分布於血管內液和血管外液體中。在健康狀況下,每小時有高達5%的血管內白蛋白漏出到血管外間隙[經毛細血管逸出率(TER)],其分布的半衰時間約為15小時。膿毒症休克時,這一比率可能會增加到20%或更多。因此,所測得的白蛋白漏出到組織的TER(所謂的「TCERA」)被稱為「血管通透性」指數。
白蛋白在液體治療中的作用仍有爭議。儘管其抗炎和抗氧化的特性被認為是有前途的,同時由於其表面負電荷與血管內糖萼之間的相互作用,使其在血管內的停留時間更長,但臨床數據一直都是相互矛盾的。雖然白蛋白的使用與MAP的改善有關,但其相對死亡率風險與晶體相似。對SAFE研究的預定義亞組分析顯示,創傷性腦損傷患者應避免使用白蛋白。相反,對慢性肝病患者推薦輸注白蛋白治療,對肝腎綜合徵患者推薦白蛋白聯合特利加壓素治療。最新版的拯救膿毒症指南也建議在接受大量晶體液復甦的患者中使用白蛋白。
液體治療的另一方面,晶體液由水和電介質組成。0.9%鹽水是第一個用於人體的晶體溶液。它的缺點是氯和鈉的非生理濃度和高滲透壓,這與腎毒性和高氯性酸中毒有關。細胞外氯化物影響入球小動脈的張力,直接影響腎小球濾過率(GFR)。因而有幾種平衡晶體液被引入臨床,例如乳酸林格氏液,醋酸林格氏液和Plasma-lyte。這些溶液具有較低的氯濃度和較低的滲透壓(在280-294mosm/L之間),並經過乳酸鹽或醋酸鹽緩衝從而保持了電中性。在健康成年志願者中,輸注2升0.9%鹽水與輸注2昇平衡晶體液對比,鹽水組尿中的水鈉排泄明顯減少。
最近的幾項RCT評估了平衡溶液與0.9%鹽水在危重病人中的效果(表 1)。在4家ICU中進行的SPLIT研究顯示,兩組患者均無獲益。SMART研究是一項單中心研究(在1個醫學中心的5個ICU中進行),在入住ICU的危重病人中把Plasma-lyte液和生理鹽水進行對比。在綜合預後MAKE30指標(由30天內任何原因死亡、新的腎臟替代治療或30天內持續腎功能不全組成)方面,Plasma-lyte液組優於生理鹽水組,具有顯著性差異。PLUS研究(把Plasma-lyte148與生理鹽水對比的研究)是一項盲法RCT,納入了5037例預計在ICU停留至少72小時且需要液體復甦的的成年患者。創傷性顱腦損傷或有腦水腫風險的患者除外。結果發現兩組之間的90天死亡率或AKI發病率並無顯著差異。同樣,BaSICS研究,這是一項在ICU中應用平衡溶液的研究,在巴西的75家ICU中進行的多中心雙盲RCT,共納入了11052例患者,把Plasma-lyte1與生理鹽水進行對比,發現兩組間的死亡率或腎臟結局均無顯著差異。一項最新的對13項高質量RCT(包括Plus和Basics研究)的Meta分析顯示,平衡晶體液組的住院死亡或28/30天死亡率更低,下降幅度達1%-9%,AKI的風險也有類似的降低。
研究不同類型晶體液對最終結果的影響的試驗,可能與患者入組前的液體輸入量和所用的液體類型有關,這可能是其中的混雜因素。事實上,對BaSICS研究進行二級事後分析,根據入組前24小時內使用的液體量和液體類型,把入組的患者進行分類,結果顯示完全接受平衡晶體溶液的患者90天死亡率降低的可能性很大。
表1.近年發表的RCT,把生理鹽水和平衡晶體液進行比較
RLS 乳酸林格氏液,AKI 急性腎損傷,MAKE30 由30天內任何原因引起的死亡、新的腎替代治療或持續腎功能不全組成,RRT 腎替代治療,SOFA 序貫器官衰竭評分
總的來說,與富含氯的溶液相比,平衡晶體溶液在膿毒症治療中可能會改善預後,目前還缺乏把平衡晶體溶液和富含氯的溶液進行成本效益分析比較的研究,因此推薦(弱推薦)平衡晶體溶液作為膿毒症休克患者的一線液體類型。
急性循環衰竭時的補液反應
在急性循環衰竭早期及早進行及時的液體復甦是一項重要的干預措施。另一方面,對於已經接受了復甦治療的患者,可用來提示是否停止(繼續)液體復甦的血流動力學目標和液體量安全範圍的指標仍相對不明確,並且很難根據具體的患者反應進行滴定。然而,有針對性的液體管理對於改善血流動力學不穩定的ICU患者的結局至關重要,因為低血容量和高血容量都是有害的。急性循環功能障礙常需要液體復甦,目的是優化CO以改善氧供。然而,目前尚無一個單一的、可靠的、可行的生理或生化指標來確定CO和氧供變化之間的平衡(即耦合「宏觀」循環和「微」循環),使急性循環功能障礙的診斷以臨床為診斷主。
然而,在認識到CO本身的價值或跟蹤其在補液之後的變化,可以發現其與常用的床旁評估指標的相關性很差。事實上,ICU醫生根據臨床檢查估計精確CO值的能力相當低,在42-62%的病例中,經常出現不一致的評估(即估計CO增加,而實際CO減少,反之亦然)。
在過去的幾十年裡,超聲心動圖在ICU中的作用發生了變化,越來越多地關注單個患者的特徵。CCE(重症心臟超聲)由ICU醫師在床旁執行並解讀,隨時都可以進行,它用助於休克類型的診斷,並根據休克類型進行治療,最後通過再次評估所採用的策略,從而指導床邊治療。由於技術問題(機器便攜性和可用性)以及缺乏針對CCE的正式培訓計劃,使得CCE的普及遇到了阻礙。最近,隨著技術的進步,在床邊就可以獲得高質量的圖像,同時歐洲危重病醫學會、美國加拿大超聲醫學會制定了新的技能認證指南和培訓標準,填補了上述空白。CCE現在應該被考慮作為ICU血流動力學不穩定患者常規評估的一部分,因為心功能評估在治療中起著核心作用。
CCE加強了血流動力學不穩定患者的臨床評估,但它應該與臨床指標相結合,用於評估氧供與氧耗是否匹配。事實上,儘管氧供「臨界」值的確切值很難評估,但克服這個閾值的系統效應是可以被識別的。
CRT(毛細血管再充盈時間)是測定指尖受壓變白後重新恢復紅潤色澤所所需要的時間。由於該操作有賴於施加的壓力,Ait-Oufella建議施加一個恰好的壓力使患者指端甲床無血色,在甲床下表現一個白色的新月形區域,持續15秒。開始液體復甦6小時後的CRT是14天死亡率的強預測因子(曲線下面積為84%[IQR:75-94])。Hernandez報導稱復甦6小時後,CRT<4秒與復甦成功相關,與發生嚴重膿毒症/膿毒症休克24小時後乳酸水平恢復正常有相關性。一項前瞻性隊列研究,納入了1320名在急診室就診的低血壓成人患者,研究顯示CRT與住院死亡率之間存在相關性。
血乳酸是一種更客觀的代謝指標,可用於指導液體復甦。無論乳酸來源如何,乳酸水平升高都與更壞的結局有關,與不採用乳酸監測為導向的復甦相比,以乳酸為導向的的復甦顯著降低了死亡率。由於血乳酸不是組織灌注的直接指標,單個血乳酸值比乳酸清除趨勢提供的信息要少。然而,血乳酸正常化表明休克逆轉,而嚴重的高乳酸血症與極差的結局相關。最近發表的文章表明,ICU中乳酸水平>4 mmol/l伴低血壓的嚴重膿毒症/膿毒症休克患者的死亡率為44.5%。例如,一項大型回顧性研究表明,ICU中嚴重高乳酸血症(乳酸>10mmol/L)患者的死亡率為78.2%,如果高乳酸血症持續超過24小時,死亡率將上升至95%。
中心靜脈血氧飽和度(ScVO2)反映了氧供與氧耗之間的平衡,它可作為混合靜脈血氧飽和度(SVO2)的替代指標(通常ScVO2比SVO2低2-3%)。它以前被當作治療膿毒症休克早期階段的一個治療目標,但是被隨後的三個大型多中心RCT的陰性結果發起了挑戰,現不再推薦。然而,與Rivers的研究相比,ARISE、PROMISE和PROCESS這三大試驗可能納入了病情不太嚴重的危重病人(例如:入組時基礎乳酸水平較低、ScVO2已處於或高於目標值,對照組的死亡率更低),膿毒症休克早期低ScVO2能恢復正常仍被當作成功復甦的良好目標。雖然當前實踐中低ScVO2的發生率很低,但高ScVO2的持續存在與膿毒症休克患者的死亡率相關,可能提示存在細胞對氧攝取的不可逆性損傷。
中心靜脈血-動脈血二氧化碳分壓差(在此以△PCO2表示)與ScVO2可給我們提供輔助性臨床信息。它可經中心靜脈導管抽取中心靜脈血、以及抽取動脈血分別作血氣分析測得,△PCO2與混合靜脈血-動脈血二氧化碳分壓差(在此以Pv-aCO2表示)具有很好的一致性,混合靜脈血可經肺動脈導管獲取,Pv-aCO2=PvCO2-PaCO2。這一點很關鍵,因為過去幾項分析休克時P(v-a)CO2變化的研究結果強調,測定中心靜脈血的PCO2來替代混合靜脈血的結果仍然是有用的。在健康人群中,△PCO2範圍是2-6mmHg。
影響這一指標的病理生理學背景比較複雜,因為在休克狀態下△PCO2變化和反映組織灌注的其它指標是耦聯的。首先,根據修正的Fick方程,△PCO2與二氧化碳生成呈線性相關,與CO呈負相關。多項臨床研究證實CO與P(v-a)CO2之間,以及微循環灌注損傷與組織PCO2之間均有密切相關性。因此,△PCO2升高可能是因為低CO所致,也可能是在CO充足的狀態下組織仍處於低灌注,微循環不足以清除更多的CO2。
這些情況可以通過整合從△PCO2和ScVO2獲得的信息來進一步研究。事實上,高△PCO2合併低ScVO2提示CO過低,而正常/升高的ScVO2合併高△PCO2提示組織灌注受損。因此,對於正常△PCO2(<6 mmHg)的休克患者,其下一步處理不應是增加CO;相反,在CO正常/升高的情況下,局部血流也可能受損。
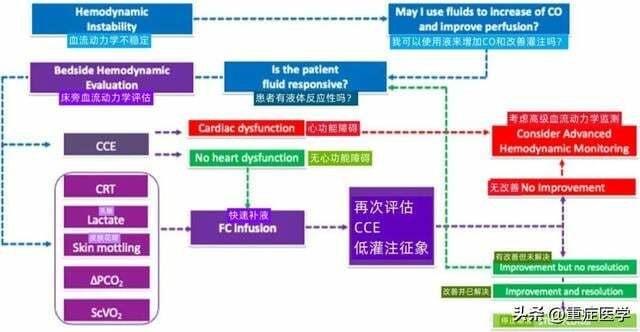
圖1. 發生急性循環衰竭時,床旁使用決策流程指導和滴定液體給藥治療。CCE 重症超聲心動圖,CO 心輸出量,CRT 毛細血管再充盈時間,FC 液體衝擊,△PCO2 中心靜脈-動脈二氧化碳分壓差,ScVO2 中心靜脈血氧飽和度。
所有這些方面都可以整合到決策流程中去,流程還把低灌注的臨床體徵與CCE評估相結合(圖1)。對全身低灌注體徵的床旁識別就可啟動液體復甦治療,以優化CO和改善氧供。我們選擇把液體當作藥物來看待,也就意味著只有它可能會增加患者CO時才去使用它。在急性循環衰竭的復甦階段就應監測液體反應性,這可以通過應用「閉環」手法策略來實現,發現存在組織灌注不足的跡象和CCE評估出相關結果,在每次輸注液體後都要再次評估。當心血管系統達到臨床反應平台時,或者更早,當CCE在患者基線檢查時顯示急性或急性-慢性心功能障礙時,更複雜的監測工具是有用的。
結論
危重病人輸液給藥的生理學是ICU的重要環節。在心血管功能和全身反應動態和複雜平衡的堅實基礎上,應把液體視為藥物,ICU醫師應認識其藥效學和生化特性,以優化治療。由於尚沒有一個單一的能夠充分評估CO和組織灌注之間平衡的生理或生化指標,因此需要一種多模態的方法。通過臨床觀察和有創血流動力學監測,將不同組織低灌注體徵的改變整合在一起,並根據重症心臟超聲對心臟功能的評估,就可以獲得患者對液體治療反應的評估。