德美論壇 | 人體放射性物質平衡研究及其輻射防護「知多少」###


人體放射性物質平衡研究
及其輻射防護「知多少」
作者:周素鳳、李康 | 審核:邵鳳

專家介紹
邵鳳,研究員,博士生導師,中國藥科大學藥物代謝動力學專業博士,南澳大學臨床研究中心博士後。現任江蘇省人民醫院國家藥物臨床試驗機構辦副主任,I期臨床研究學術帶頭人。入選江蘇省第四期「333高層次人才培養工程」,江蘇省第十四期「六大人才高峰」高層次人才;2020年獲第七屆江蘇醫藥科技獎「醫藥科技進步獎二等獎」;同時兼任「中國醫藥質量管理協會智能化藥物臨床研究專業委員會」副主任委員;江蘇省藥理學會臨床藥理專委會副主任委員,南京醫科大學第一附屬醫院(江蘇省人民醫院)倫理委員會委員,十三五重大專項「創新藥臨床評價的同位素示蹤技術平台」子項目負責人。作為PI負責I期臨床項目50多項,第一或通訊發表SCI文章40多篇。
導語:
為鼓勵和引導工業界規範開展放射性標記人體物質平衡研究,中國國家藥品監督管理局(NMPA)於2023年7月24日發布了《放射性標記人體物質平衡研究技術指導原則(徵求意見稿)》[1]。指導原則對該研究開展時機、研究目的、研究設計、受試人群、劑量選擇、標記位點、給藥途徑及製劑、樣本收集和處理、樣本分析、及結果報告等關鍵問題給出了詳細的指導建議。美國食品藥品監督管理局(FDA)也於2022年5月頒布了《Clinical Pharmacology Considerations for Human Radiolabeled Mass Balance Studies》指導原則草案[2],本文主要為大家介紹放射性物質平衡研究的結果解讀及輻射防護方面的內容。

1.什麼是放射性物質平衡研究?
人體放射性物質平衡研究是採用放射性同位素(通常為14C或3H)標記藥物(給藥物分子裝上GPS),研究藥物在體內的吸收、代謝、排泄的過程,精確評價藥物在體內的物質平衡、代謝轉化、及鑑定代謝物的結構信息,為藥物相互作用、肝/腎功能損傷、生物利用度等研究的開展提供參考,是創新藥早期臨床藥理學研究的重要內容。採用放射性同位素標記技術是進行藥物體內物質平衡及代謝轉化研究的「金標準」。通俗來講,通過該項研究可以清楚的知道藥物多少進入體內?變成了什麼?排出了多少?獲得藥物詳盡的藥動學數據。該研究前期準備及研究設計考慮要點詳見圖1。
一般情況下,應對所有的新分子實體開展物質平衡研究。針對以下特殊情況可不開展[1,2]:①可從文獻或藥品監管機構批准的產品說明書中獲得物質平衡研究結果的藥物;②基於基礎藥理學和非臨床ADME信息,已知代謝和消除途徑的藥物,如單克隆抗體、內源性物質及類似物(如多肽、激素、寡核苷酸治療藥物);③尿液中藥物回收率達到90%或以上,且主要為原形藥物(代謝很少);④沒有或可忽略系統暴露量的藥物(如滴眼給藥、皮膚局部給藥等途徑的藥物)。
圖1人體放射性物質平衡研究準備工作及研究意義



2.國內外開展概況
據FDA一項調查表明[3],2014-2018年批准的小分子藥物中,約66%開展了放射性物質平衡研究,幫助了解藥物的藥動學特徵,並為藥物整個開發計劃提供必要的信息,可見此研究結果對藥物研發的重要性。截止2023年7月31日,CDE臨床試驗登記平台累計登記了100餘項放射性物質平衡試驗,國內已經有多家I期臨床研究中心可以開展14C物質平衡研究的臨床試驗。其中江蘇省人民醫院為國內首家開展人體14C標記物質平衡研究的中心,目前中心已建成國內領先、達國際水平的以14C同位素示蹤技術為特色的I期臨床研究平台,已完成10餘項人體14C物質平衡研究,其中呋喹替尼、安羅替尼、恩沙替尼、阿美替尼、奧雷巴替尼、貝福替尼等新藥均已上市。
3.研究結果解讀
3.
01
循環系統中代謝產物
通過對血漿代謝物譜的定量和鑑定,可評估在人體內是否存在特有的代謝產物及高比例藥物代謝產物,與臨床前數據進行比較,根據《藥物代謝產物安全性試驗技術指導原則》[4]決定是否需開展代謝產物的非臨床安全性評價。
02
主要消除途徑
獲得血漿、尿液和糞便中的代謝物譜後,應對其中的代謝物進行結構鑑定,結合體外研究結果確定產生主要代謝產物的代謝酶,以獲得研究藥物在人體內的生物轉化途徑,明確藥物的主要消除途徑。如果某種酶或者某一消除途徑對藥物消除存在顯著貢獻,應根據DDI指導原則、肝/腎功能不全患者藥動學研究技術指導原則等開展相關研究。
03
物質平衡回收率
EMA[5]、FDA及NMPA指導原則中均指出物質平衡研究的總回收率原則上應達到90%,一般情況下建議鑑定排泄物中80%以上的回收的放射性物質,目的是確保不遺漏重要的消除途徑。
回收率低時應提供合理的解釋,可能的原因包括[6, 7]:製劑配製、運輸、劑量分析測定錯誤或不準確;受試者依從性差,排泄物收集不完整或樣本丟失;嘔吐物、唾液樣本未收集; 14C標記位點不佳(代謝為14CO2呼出或參與內源性物質合成);儀器檢測靈敏度的限制;循環系統放射性半衰期長;藥物在特定組織存在滯留或與大分子共價結合、肝腸循環等。


人體放射性物質平衡研究
4. 開展過程中的輻射安全考量
人體放射性物質平衡研究因其研究藥物具有放射性的特殊性,需要建立放射性藥物及生物樣本的全流程管理體系(包括運輸、儲存、使用及處置等環節),涉及的單位和人員均應符合國家法律法規的要求,全過程可追溯。研究需有符合放射防護要求的專用試驗場地,包括放射性藥物儲存區域、給藥區域、生物樣本處理區域、放射性廢棄物處置區域等。事實上,輻射是天然存在的,衡量輻射劑量的度量單位,醫學上一般採用毫希弗(mSv)來衡量輻射的危害性。宇宙及環境中均存在一定的電離輻射,國際文獻報告平均每人每年天然受照劑量約為3.6 mSv;一次胸透大約吸收量為1.1 mSv;一次胸部CT大約吸收量為5.7 mSv。所有離開劑量談「毒性」的行為,都是不嚴謹的。談「輻」色變,大可不必。
那麼,在物質平衡研究中對輻射安全的考量主要從以下三個方面:外照射風險、內照射風險以及環境安全。

4.1外照射風險
外照射指放射性藥物不進入人體內所引起的照射。本研究中的外照射主要考慮對研究者(如醫護、樣本處理人員)的風險。14C或3H在衰變的時候,會放射出低能量β射線粒子,該射線粒子具有非常低的穿透能量。受試者給藥的放射性劑量很低,在如此低的放射性水平下,一張普通的白紙或者人體完好無損的皮膚就能夠有效阻擋絕大多數生物樣本中發射出來的電離輻射。

圖2一張普通的白紙(左)或者實驗室手套能夠有效的阻擋3H和14C放射出的β射線粒子
4.2內照射風險
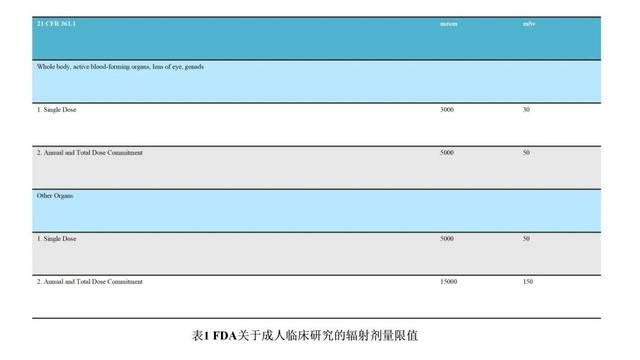
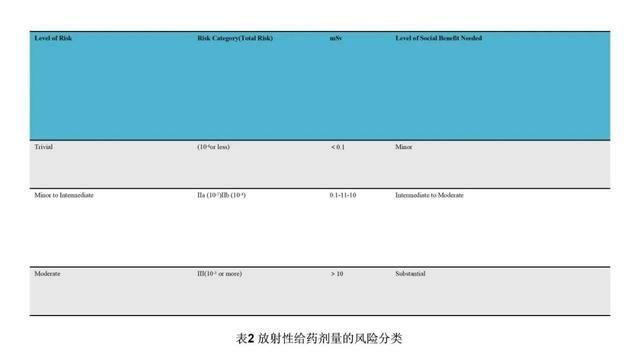
內照射是指放射性核素進入生物體,使生物收到來自內部的射線照射。β射線輻射主要為內照射,內照射主要考慮對受試者的風險。美國聯邦法案21 CFR PART 361.1規定:對於年滿18周歲的成年受試者,參加單個研究或1年內參加多項研究累積的輻射劑量如果超過以下劑量,則一般會被認為是不安全的:對於全身、活躍的造血器官、晶狀體和性腺:單次劑量為30 mSv,多次劑量和年劑量總和為50 mSv;其他器官:單次劑量為50 mSv,多次劑量和年劑量總和為150 mSv(表1)。物質平衡研究放射性劑量是依賴臨床前動物的物質平衡及組織分布(定量全身放射自顯影,QWBA)結果,進行人體輻射劑量的估算。在估算的結果範圍內,結合檢測的要求,依據可達到合理的最低水平(as low as reasonably achievable, ALARA)原則,最終確定給予人體的放射性劑量。1977年世界衛生組織提出並經國際輻射防護委員會(ICRP)第62號出版物修訂文件所述,應根據研究中受試者接受的放射劑量進行危險度分類,對研究的風險與受益進行評估(表2)。研究中放射性劑量很低,通常≤100 μCi(約80%左右),吸收劑量一般小於1 mSv。按照該危險度分類,絕大部分屬於IIa類風險,安全性是可接受的。
參與本研究的醫護人員或樣本處理人員僅直接接觸藥物、血液、排泄物,可能會有少量內照射發生;因此工作人員在接觸生物樣本時,應做好相應的個人防護,防止食入或經體表進入。在進行相應操作時,應著實驗服及一次性醫用隔離衣;佩戴好手套、帽、鞋套;禁止在污染區進食、吸菸。
4.3環境安全
14C的衰變半衰期相對較長,假設,1貝克的14C標記化合物泄露到實驗台上,那麼需要等5730年後,其放射性活度才會衰減到0.5貝克。因此,必須嚴格遵循實驗室安全操作規程,避免污染環境。所有允許進行放射性同位素操作的實驗區域應該配備一個表面污染檢測儀,用以檢測可能會發生的泄露,除此之外,同樣需要進行常規和非常規的擦拭實驗,以監測實驗區的污染狀況。試驗過程中所產生的放射性固體廢物、液體廢物和其他生物樣本,各類樣本需分類收集,統一移交至具有放射性廢物處理資質的單位,按要求進行處理,最大程度減少放射性污物對周圍環境和人員的影響。
5.總結
人體物質平衡研究應基於藥物整體的研發策略,結合藥物的特性、臨床研究整體進度進行科學、合理地設計和考慮。同時結合藥物特殊性充分考慮實施過程中風險並進行充分的評估,做好相關人員(包括研究者、受試者等)的培訓及各項應急預案,以保證研究的圓滿完成。
素材來源:諾和德美